自體脂肪幹細胞治療移植治療關節炎 特管法第二例通過 (林口長庚+向榮生醫)
一月 23, 2020既亞東醫院之後,林口長庚與向榮生醫也取得衛福部特管法的通過,現在病患除了有新的療法之外,也有第二個選擇,從CDE的細胞治療治療技術揭露平台來看,以單腳單次注射來看,目前長庚的售價為23萬,而亞東的售價為34.2萬,兩者的售價差異的確不小,長庚與向榮這邊明顯便宜了許多。
向榮生醫科技
一月 21, 2020| 申請案號 | 108DOMA002 |
| 計畫狀態 | 執行中 (On Going) |
| 細胞治療項目 | 自體脂肪幹細胞移植 |
| 適應症 | 退化性關節炎及膝關節軟骨缺損 |
| 適應症詳述 | 退化性關節炎 |
| 醫療機構規模 | 醫學中心 Medical Center |
| 醫療機構所在行政區 | 桃園市 |
| 醫療機構地址 | 桃園縣龜山鄉復興街五號林口關節重建骨科 |
| 連絡資訊 | https://www.cgmh.org.tw/ 特約門診專線:03-3280070、03-3281200*8716 |
| 全部操作醫師 | 張毓翰 |
| 費用說明 | (費用尚待地方衛生局核定) 1管供病人單腳單次注射,預估費用23萬,採分段付費方式。 2管供病人雙腳單次注射,預估費用23萬5,000元,採分段付費方式。 |
| 費用收取方式 | (費用尚待地方衛生局核定) 1.1管:收費方式為分階段付費,共分三次收費。第一階段收抽脂費用約5,000元及細胞製備費用約97,500元,第二階段收脂肪幹細胞注射約30,000元及細胞製備費用約58,500元,第三階段收細胞製備費用約39,000元。 2.2管:收費方式為分階段付費,共分三次收費。第一階段收抽脂費用約5,000元及細胞製備費用約100,000元,第二階段收脂肪幹細胞注射約30,000元及細胞製備費用約60,000元,第三階段收細胞製備費用約40,000元。 3.風險發生之收費方式: a.第一階段-1:若病人於採集脂肪組織時發生檢體量不足之情形,無法完成細胞產品,收取約6,500元製備相關費用。 b.第一階段-2:若因以下狀況無法完成療程:(1)醫師判定無法進行療程(2)病人自行中斷治療(3)其他因素,但已完成檢體處理及培養一週,1管收取約55,000元製備相關費用,2管收取約87,300元製備相關費用。 c.第一階段-3:若因以下狀況無法完成療程:(1)醫師判定無法進行療程(2)病人自行中斷治療(3)其他因素,但已完成檢體處理及培養二週,1管收取約99,400元製備相關費用,2管收取約128,300元製備相關費用。 d.第一階段-4:若因以下狀況無法完成療程:(1)醫師判定無法進行療程(2)病人自行中斷治療(3)其他因素,但已完成檢體處理及培養三週,1管收取約152,200元製備相關費用,2管收取約182,400元製備相關費用。 e.第一階段-5:若因以下狀況無法完成療程:(1)醫師判定無法進行療程(2)病人自行中斷治療(3)其他因素,但整個製程已完成,1管收取約189,800元製備相關費用,2管收取約194,800元製備相關費用。 |
| 計畫書核准期間(起日) | 1/13/2020 |
| 計畫書核准期間(迄日) | 1/12/2023 |
| 細胞製備場所 | 向榮生技實驗室 |
| 細胞製備場地址 | 11494台北市內湖區行愛路77巷65號6樓 |
| 附檔 | 無 |
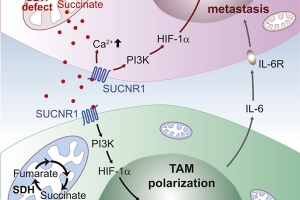
國衛院首度發現琥珀酸在腫瘤微環境扮演關鍵角色
一月 21, 2020國光生技董事會通過建廠計劃 啟動全方位生技廠區建置
一月 18, 2020國光生物科技股份有限公司(4142)董事會於1月14日會議中通過「全方位生技廠區」願景計畫,將啟動新的細胞培養廠、破傷風疫苗廠、增擴支援系統及倉儲、品管實驗室及辦公室等興建,預計各項建置將於111年及112年逐步完成。
2021.07.11 l 2021 亞太國際藥理學會議(APFP)
一月 17, 2020亞太國際藥理學會議是亞太地區藥理醫藥學者每四年舉辦一次的重要國際學術研討會,台灣藥理學會很榮幸主辦第十四屆大會(2020年5月4日-7日,2020 APFP,於台北國際會議中心),本屆將邀約世界知名演講者,包括2018年度諾貝爾獎生理醫學獎得主Tasuku Honjo博士闡述免疫療法的前瞻發展,翁啟惠前中研院院長將探討疫苗開發在免疫治療的進展。
Biologics World Taiwan 已穩步確立其地位,成為台灣的生物製藥聚會,以尋求新的合作夥伴關係,構想和知識。它的參會人數年復一年地增長了一倍,有100%的參會者認為這次會議是一次非常有益的體驗。我們很自豪能夠繼續提供會議平台,使台灣的生物製藥產業處於發展中的中心地位,在其新生物藥物研發和生物製造的快速發展方面受到越來越多的全球關注。
免疫療法可以成功治療神經膠母細胞瘤(GBM)嗎?
一月 16, 2020藉由免疫系統參與攻擊腫瘤而起作用的癌症治療方法已被證明可有效抵抗越來越多的癌症。到目前為止,一個值得注意的例外是腦癌,包括成膠質細胞瘤(Glioblastoma multiforme, GBM),這是成人中最常見的腦癌類型,也是原位腦癌中最惡性最棘手的腦瘤。儘管數十年來一直在努力開髮膠質母細胞瘤的新療法,但沒有一個能明顯改善患者的壽命。實際上,大多數患有這種腦癌的人存活不到2年。
2020.03.20 l 幹細胞與再生醫學國際研討會(基礎研究、產學應用、法規探討)
一月 10, 2020為更落實推動國內幹細胞與再生醫學相關產業與國際接軌,由科技部推動成立的「人類疾病誘導型多潛能幹細胞服務聯盟」與中央研究院生醫所謹訂於109年3月20日舉辦「2020 幹細胞與再生醫學國際研討會: 基礎研究、產學應用、法規探討」研討會。
深入認識CAR-T免疫細胞療法
一月 08, 2020多年來,癌症治療的基礎是手術,化學療法和放射療法。在過去的二十年中,Gleevec® 和Herceptin®等抗體標靶治療藥物透過能辨認癌細胞中的特定分子變化而達到殺癌細胞的藥物,也已鞏固了它們作為許多癌症的標準治療方法。 但是在過去的幾年中,免疫療法已成為一種被癌症界稱為癌症治療的“第五支柱”的療法,這種療法具有增強和增強患者免疫系統攻擊腫瘤的能力。
FDA批准CAR T用於成人非霍奇金淋巴瘤治療
九月 01, 20182018年5月1日,美國食品藥品監督管理局(FDA)批准了針對患有某些類型的非霍奇金淋巴瘤的成年人的CAR T細胞療法tisagenlecleucel(Kymriah),使其成為第二種被FDA批准用於淋巴瘤的 CAR T細胞療法。
New Articles
Cell Therapy














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)