包括仲恩生醫、宣捷幹細胞、生寶臍帶血、向榮生醫、國璽幹細胞及台寶生醫等公司,其中國璽幹細胞於2017年3於竹北生醫園區進行建廠,預計於國內建設一間符合PIC/S GMP的幹細胞製劑藥廠,可以看出業界對於幹細胞新藥的開發已投入相當多的資源及資金。
而細胞治療其中最重要的一個過程就是細胞的培養,而細胞之所以能在體外存活生長其主要就是依靠培養基(medium)中的養分,因此,培養基在細胞治療中扮演這非常重要的角色。那麼,到底要用什樣的培養基呢? 哪一些培養基能夠使用於臨床應用呢? 從法規面來看,在台灣目前將需經由培養放大的細胞治療產品將視為新藥(有一些符合最小操作定義的,屬於醫療行為),與一般小分子藥物或生物製劑並無差別,上市前皆需進行臨床前試驗及臨床試驗,在這些試驗中,為了確保藥物的安全性,藥物的製備過程在不同的試驗階段分別需符合GLP, GTP或PICS/GMP等規範,而在細胞治療產品中,其待測藥物就是細胞本體,因此,用於培養細胞的培養基,其生產流程市遵循cGMP或ISO的規範,表示該產品的品質已達到國際標準,產品的穩定性及可靠度相對值得信賴;而培養基在細胞治療中被認為是”輔助性材料”,這也表示培養基是屬於會與最終醫療產品直接接觸的材料,因此,對於細胞治療產品來說,能使用遵循cGMP規範的廠房所生產的培養基是必要的,可減少產品相關的風險,以免危及最終的醫療產品,畢竟cGMP的目的就是要確定任何潛在的危害並將其降至最低。以培養基來說,其屬於輔助性材料,在法規上要求輔助性材料儘量採用藥典等級或臨床等級,若不可行而採用研究用等級,須提供檢驗成績書(COA),以評估該試劑是否還需實施其他的檢驗或測試,在這種情況下,符合cGMP規範所生產的產品,其穩定度及可靠度較高,使用上是較沒有疑慮的。
培養基種類的選擇
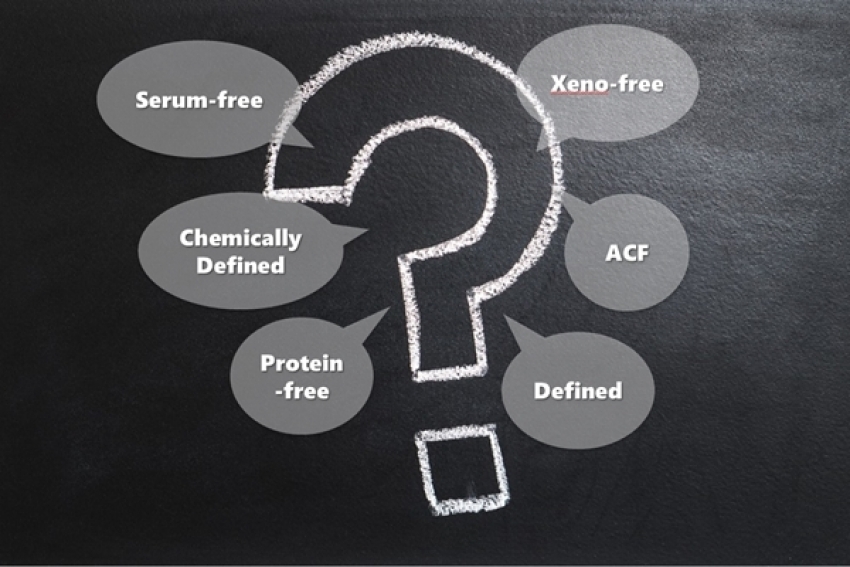
接下來就是培養基種類的選擇,目前用於培養人類間質幹細胞的培養基主要簡單可分成三類,分別是含胎牛血清(FBS)、serum-free及xeno-free培養基。目前國際上使用含有胎牛血清的培養基比例還算蠻多的,雖有成本的優勢,但從臨床應用角度去評估,其實是不建議使用的,因為FBS的成份非常複雜且屬於異種來源,未來若要將該細胞製劑打入人體,可能需擔心成分殘留的問題,殘留的成分可能造成複雜的免疫反應,潛在的新型的人畜共通傳染病,且每個批次FBS的成份皆有所差異,這會導致培養基品質的穩定較差,進而會難以控管細胞產品之品質,再來就是供貨的穩定性,畢竟FBS是動物來源,產量就不容易掌控,長期來看貨源的穩定性將是一個潛在的隱憂。
使用人類血小板裂解液(human platelet lysate, HPL)當作培養基的主要添加物則是近年來比較新的方式,已有許多實驗證實hMSC可以在含有HPL的培養基中有良好的生長狀況,且可維持該細胞的特徵,且這也是屬於 Xeno-free的條件。由於血小板內含許多生長因子可支持細胞生長,且使用的是人類的來源,因此,相較於FBS,使用HPL可以避免異種來源可能導致的免疫反應;雖有以上之優點,但還是有一些風險性的問題需要注意,HPL內含物成分複雜且存在批次差異,另外,由於廠商主要是去收購血庫中過期的捐贈者血液在進行血小板的分離,因此HPL中是否殘存未被偵測出的病菌,這也是一個潛在的風險;因此,若確定的要使用HPL來培養hMSC,則使用單位必須自行做好進料的檢驗,且必須特別注意製造商的品管,是否能提供完整的產品出廠驗證及來源等資料,並確認該產品製造商是否是遵循cGMP規範進行生產。
使用serum-free & xeno-free 培養基則是目前最熱門的選項,若其培養基還有特別表明為chemically defined的話,則表示因為此類型的產品屬於內容物成分清楚且其濃度及含量皆為已知,此類型的培養基因為是全人工合成,所有原物料接受管控,因此不須擔心有批號之間的差異問題,當然也較能預估產量,供貨穩定性也較高,當然,最重要的是主要的成分並不含血清及任何異種來源的蛋白成分,因此在使用上也不需擔心因為殘留而導致的潛在風險。目前此類型的培養基已經越來越成熟,超過十種以上的國際品牌皆有推出類似的商業化產品,目前在國際上也已經有使用此類型的培養基的細胞治療產品正在進行臨床試驗,特別要注意的是,標示chemically defined的培養基,其內容物所使用的成分,生產過程也必需要是要在chemically defined的環境中進行。
預計未來國內也會開始應用serum-free、xeno-free和chemically defined培養基為主,相信未來這類型產品的市場會持續增加。在選擇時可以考慮以下幾點:
1. 生產製造是否為cGMP等級
2. 是否能提供詳細的產品使用說明及技術支援
3. 國際上是否有臨床應用的實驗案例
4. 國內是否有代理商
5.是否能提供DMF or MF(Drug master file or master file)
針對市面上較常見產品,簡單的做了一些比較給大家參考,如下表。
當然,培養基的選擇相當重要,絕對不是容易的事,且在特定的治療目的下,無血清培養基也不一定就是最佳的選擇方案,另外,當你決定要從含有血清的培養基置換成無血清的培養基,一定要謹慎考慮各種條件來進行評估及篩選。
| Manufacture | Product | SF/XF/ACF | 保存期間 (Complete medium) |
MSC 來源類型 | cGMP/DMF/IVD |
|
Sartorius (Biological Industries) |
MSC NutriStem® XF medium | SF,XF,Defined | 30 days |
Bone marrow |
GMP (ISO13485) / DMF |
| Stemcell Technologies | MesenCult™-XF Medium | SF,XF,ACF | 14 days | Bone marrow Adipose | For research use only |
| Thermo Fisher | StemPro® MSC SFM XenoFree | SF,XF | 14 days | MSC or Adipose | cGMP/ research use only |
| Thermo Fisher | CTS StemPro MSC SFM | SF | 30 days | MSC or Adipose | DMF/For Human Ex Vivo Tissue and Cell Culture Processing Applications/ Research Grade |
| Lonza | TheraPEAKTM MSCGMTM Mesenchymal Stem Cell Growth Medium BulletKitTM | SF | 30 days | Bone marrow, Adipose, Dental pulp | GMP |
| Miltenyi Biotec | StemMACS MSC Expansion Media XF | SF,XF | 7 days | Bone marrow | For research use only |
| Xcell | CellCor ™ CD MSC | Chemically Defined |
Bone marrow |
GMP, ISO13485 |












![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)