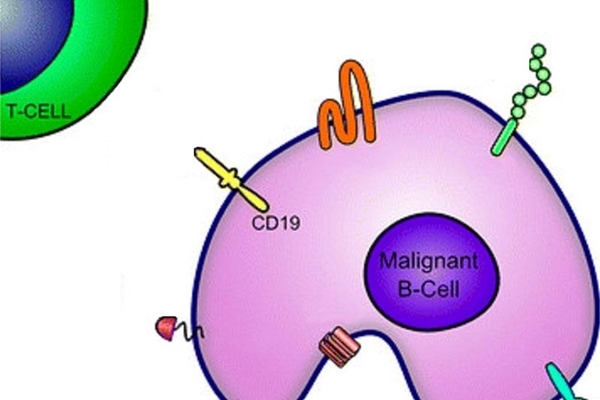
去年,FDA批准了另一種CAR T細胞療法axicabtagene ciloleucel(Yescarta),用於治療瀰漫性大B細胞淋巴瘤(DLBCL)。CAR T細胞療法是一種免疫療法,涉及一次性輸注患者自身的免疫細胞,這些患者的免疫細胞已經過基因改造,可以識別和攻擊癌症。tisagenlecleucel和axicabtagene ciloleucel靶細胞(癌變的和正常的)都在其表面表達稱為CD19的分子。
Tisagenlecleucel是第一個獲得FDA批准的 CAR T細胞療法。它於2017年被批准用於治療兒童和青少年白血病。
tisagenlecleucel的新批准用於淋巴瘤,特別是DLBCL,高級B細胞淋巴瘤和由濾泡性淋巴瘤引起的DLBCL,在先前治療後又復發或惡化。
NCI 癌症研究中心淋巴瘤治療部門負責人Wyndham Wilson博士說,Tisagenlecleucel“絕對填補了一個重要的市場。” 威爾遜博士補充說:“但是它的影響,至少起初是有限的”,因為這種治療是完全個性化的,並且僅在某些癌症中心可用。
約60%至70%的DLBCL患者對其初始治療有持久的反應。威爾遜博士解釋說,對於那些初治後DLBCL無反應(難治性疾病)或複發(復發)的人,“用傳統療法治愈[這些患者]的能力非常有限”。
同樣,由濾泡性淋巴瘤引起的DLBCL可能難以治療,其中某些患者的長期預後較差。患者接受濾泡性淋巴瘤治療後,濾泡性淋巴瘤有時可轉化為DLBCL。
威爾遜博士說,FDA的新批准提供了另一種CAR T細胞療法,“可能治愈某些[DLBCL]患者,而其他方法無法治愈。”
資訊來源: NCI














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)