此為全球首次發現mir-17~92具有作為預測漸凍症發病的生物標記,可改善漸凍症小鼠病徵,此實驗結果已申請專利,有助於未來以基因治療漸凍症標靶藥物的研發。研究成果已於今(108)年5月30日刊登於國際期刊《細胞:幹細胞》(Cell Stem Cell)。
漸凍症是一種運動神經元退化導致的疾病,從控制四肢的運動神經元開始發病。患者初期因為感到手腳無力而就醫,但此時體內的運動神經元已開始出問題並迅速退化,短期內便無法行走或靈活使用雙手,最後只能漸漸躺臥在輪椅中,大多死於呼吸衰竭。
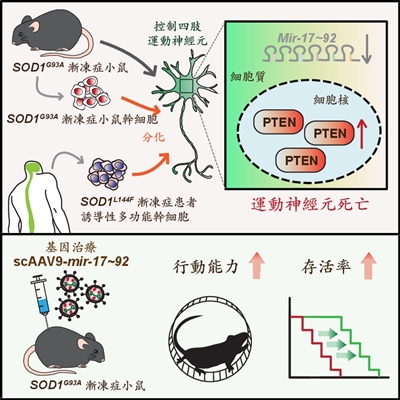
mir-17~92和PTEN [2] :影響運動神經元退化的關鍵
本次發現的漸凍症致病機轉,奠基於陳俊安先前的基礎研究成果,他發現小鼠胚胎裡的mir-17~92大量表現於中樞神經系統裡控制四肢肌肉的運動神經元。由於PTEN蛋白質累積在運動神經元細胞核,導致細胞退化死亡;mir-17~92可抑制PTEN蛋白質的表現量,阻擋蛋白質進入細胞核中,進而保護運動神經元存活,阻止控制四肢的運動神經細胞凋零。陳俊安研究團隊透過實驗發現,當小鼠胚胎的運動神經元失去mir-17~92時,因無法抑制PTEN的表現量,導致PTEN增高並進入細胞核裡,造成控制四肢肌肉的運動神經元死亡。
本篇研究為驗證mir-17~92是否也在漸凍症的運動神經元退化上扮演關鍵角色,陳俊安採用多種生物模式系統做病理驗證,包括小雞胚胎、SOD1G93A [3] 漸凍症小鼠以及其幹細胞分化之運動神經元、漸凍症患者的誘導性多功能幹細胞所衍生之運動神經元(iPSC~MNs [4] )等,觀察mir-17~92的作用與表現後,均得到一致的結果。
mir-17~92可望應用於「漸凍症」的預測與治療
陳俊安解釋,原本應該大量表現於四肢運動神經元的mir-17~92,在漸凍症小鼠發病(四肢運動神經元死亡)前會顯著減少,導致PTEN逐漸累積在細胞核中,最後細胞退化死亡。
令人振奮的是,研究團隊將SOD1G93A漸凍症小鼠體內的mir-17~92表現量提高,發現可以延緩小鼠癱瘓的時間,顯著增進其運動能力,小鼠壽命也平均延長14%。
由於目前漸凍症患者發病後平均壽命僅二至五年,若將mir-17~92的基因治療應用於人體上,可望為漸凍症治療帶來一道曙光。本研究發現mir-17~92與漸凍症發病的關聯性,也為「解凍」漸凍症的致病機制往前推進了一步。
此研究由本院、國衛院以及科技部支持。共同第一作者為本院分生所董盈岑博士和彭冠智;通訊作者為本院分生所董盈岑博士和陳俊安副研究員。研究團隊成員包含:陳彥中醫師、張綿、顏雅萍博士和瑞典卡羅琳大學醫院的Sebastian Thams博士。
論文名稱:Mir-17∼92 Confers Motor Neuron Subtype Differential Resistance to ALS-Associated Degeneration。
論文連結:https://www.sciencedirect.com/science/article/pii/S1934590919301651?via%3Dihub
[1] RNA 有兩種: 一種是負責製造蛋白質的 mRNA (messenger RNA) ,另一種是ncRNA (non-coding RNA) ,不負責製造蛋白質。mir-17~92是一種小分子的 ncRNA,亦即 microRNA,幫忙「踩剎車」,辨認基因序列相對應的標靶 mRNA ,並與之結合,進而抑制標靶 mRNA 製造蛋白質。本研究發現的mir-17~92,其一作用為抑制PTEN 蛋白質、與控制PTEN進核蛋白質的量。
[2] PTEN 是一個有生長抑制作用的抑癌基因,可促進癌細胞的死亡;本文則研究PTEN 對於神經細胞的影響。
[3] 此為SOD1基因缺陷漸凍鼠,已知有許多基因突變會造成漸凍症,SOD1是最早被發現,研究最為透徹的一員。
[4] 一般人的體細胞已定型,不像受精卵或胚胎幹細胞具有分化出各式細胞種類的能力。誘導性多功能幹細胞(iPSC),是利用導入特定轉錄因子,將體細胞轉變成類似胚胎幹細胞的多功能幹細胞。運用這個方法,可以直接將患者的血球細胞,變成iPSC,再分化成運動神經元(iPS~MN),讓科學家不需要侵入性地將患者神經元取出來做研究。
資料來源: 中央研究院














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)