TIL 和 CAR T 細胞療法之間存在關鍵差異
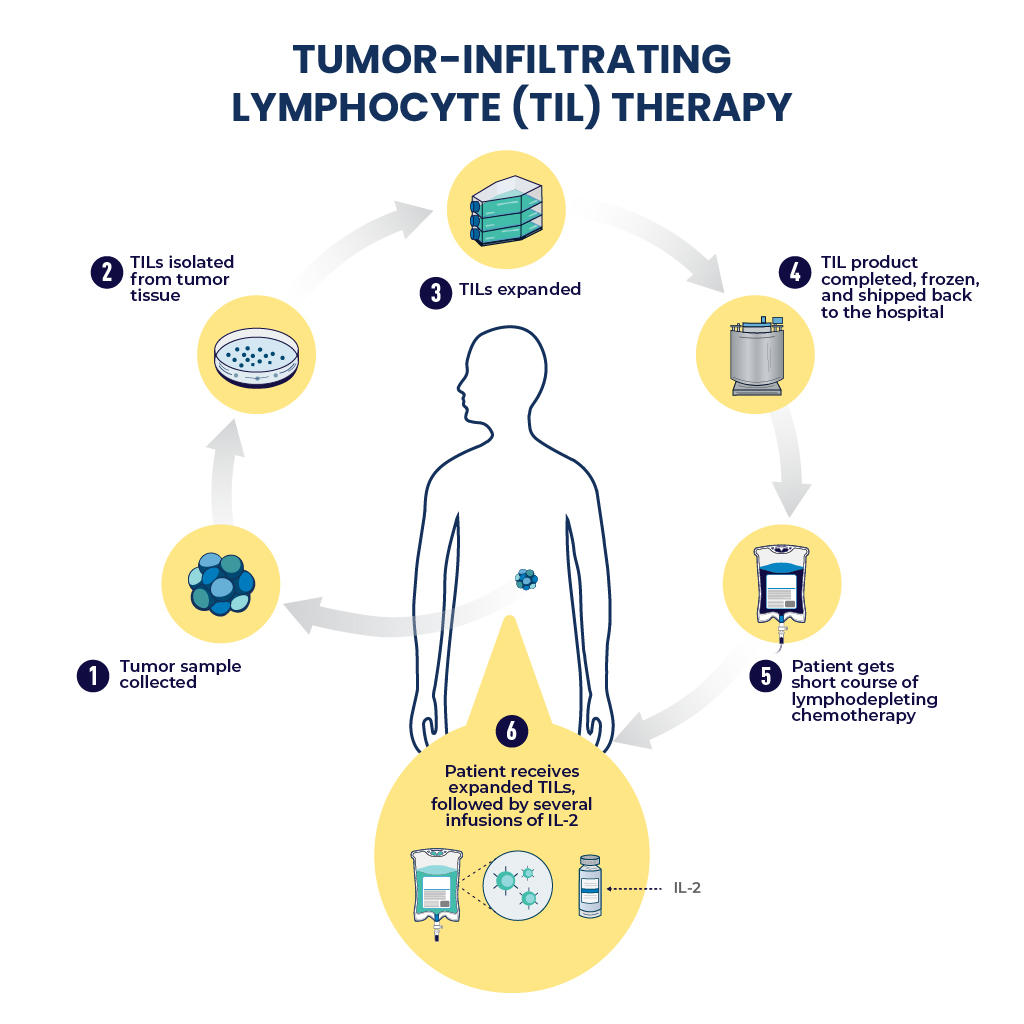
對於已批准的 CAR T 細胞療法,T 細胞是從患者的循環血液中收集的。相較之下,對於 TIL 療法,T 細胞是從患者的腫瘤中收集的。
Lifileucel 的批准是基於Iovance Biotherapeutics 贊助的一項臨床試驗的結果。在接受 FDA 最終批准的 lifileucel 劑量在治療的 70 多名參與者中,近三分之一的人其腫瘤大小至少有所縮小(腫瘤反應),一些參與者的腫瘤完全消失(完全反應)。此外,約 40% 的癌症對 lifileucel 有反應的患者在接受一次性輸注治療一年後,癌症病況沒有惡化。
TIL 療法是由 Steven Rosenberg 和他在 NCI外科分部的同事首創。 1980 年代末,Rosenberg 博士領導了首次 TIL 療法的臨床試驗,結果顯示該療法可以縮小晚期黑色素瘤患者的腫瘤。 (Rosenberg 博士最近因其在免疫療法方面的工作(包括 TIL 療法的開發)而獲得了美國技術和創新最高獎。)
在接下來的幾年裡,NCI 研究人員進一步完善了 TIL 療法的製造和提供流程。 2011年,NCI與Iovance簽訂了合作研究協議,以進一步開發這種特殊的TIL療法,包括進行更大規模的臨床試驗和開發製造基礎設施,為FDA批准鋪路。羅森伯格博士承認,這已經是很長一段時間了。他說,新的批准“是一大進步”,這表明“細胞療法正在加入癌症治療的主流。”
只需要一點幫助的 TIL
FDA 已批准六種不同的 CAR T 細胞療法,所有這些療法都用於治療白血病和淋巴瘤等血癌。
透過CAR T細胞療法,收集的免疫細胞在實驗室進行基因工程,使其能夠識別癌細胞並增強殺死癌細胞的能力。接下來,它們會生長或擴大到數億個,然後注射到患者體內。
放大
腫瘤浸潤淋巴細胞 (TIL) 是從患者自身腫瘤中收集的 T 細胞。一旦從腫瘤樣本中分離出來,TIL 就會擴大到數十億個並回輸到患者體內。
圖片來源:國家癌症研究所
使用 lifileucel,收集的 T 細胞在擴增前不會經過改造。羅森伯格博士解釋說,這是因為,從腫瘤組織樣本中收集的它們已經證明它們可以識別並導航到腫瘤,這種辨識依賴於腫瘤細胞表面特定異常蛋白質或抗原的存在。
但是,就像潛入銀行但沒有打開保險箱的工具的強盜一樣,收集到的 TIL 缺乏完成工作所需的能力或支援。 TIL 需要的是增援——大量的增援——以及一些激勵。
因此,儘管從患者腫瘤中收集的 TIL 並未發生基因改變,但在製造過程中還是採取了一些措施,包括將它們與一種名為IL-2的藥物混合,以幫助它們擴展成數十億個抗癌免疫細胞。
此外,作為 lifileucel 治療的一部分,採取了兩項措施來增強輸注的 TIL 攻擊癌症的能力及其整體效力。首先,在接受 lifileucel 治療前幾天,患者要接受幾輪高劑量「淋巴球清除」化療。其次,在輸注 lifileucel 後不久,他們會接受數劑 IL-2。
lifileucel 對腫瘤反應的持久
FDA 的批准是基於試驗中 73 名患者的數據,這些患者的癌症在接受PD-1 / PD-L1靶向免疫檢查點抑製劑或BRAF 抑製劑治療後病情惡化,且其lifileucel 劑量至少為75 億個細胞(批准中指定的劑量)。
2023 年 12 月,在歐洲腫瘤內科學會 (ESMO) 2023 年免疫腫瘤學大會上報告了該試驗中 153 名患者的長期研究結果,這些結果在很大程度上反映了這 73 名患者的研究結果。
當 48 名癌症患者 (31.5%) 對 lifileucel 治療有反應時,超過一半的人至少存活了一年,且沒有任何癌症惡化的證據。這些反應中約有 10% 是持續的——也就是說,仍然沒有證據表明他們的癌症正在惡化——而且幾乎所有反應都持續了數年。
該試驗的主要研究人員之一、德國德勒斯登大學的醫學博士、哲學博士 Martin Wermke 在 ESMO 會議上報告說,最長的持續反應長達近 5 年。
Wermke 博士說,研究人員計劃對所有患者進行 lifileucel 輸注後 5 年的追蹤。他繼續說,根據迄今為止的結果,研究人員預計,任何有持續反應的參與者的癌症都不會惡化或復發。
誰會對 lifileucel 做出反應?那麼副作用呢?
Wermke 博士解釋說,較大患者群體的結果提供了一些線索,可能有助於確定誰最有可能對 lifileucel 產生反應。
例如,在 153 名患者中,大約有一半的癌症擴散到大腦或肝臟,但很少有人做出反應。對於腫瘤負荷較大(即體內有大量癌症)的人來說,反應也不太可能。
他指出,這些發現表明,如果在癌症擴散到身體的許多其他部位或單一腫瘤變得相當大之前給予 lifileucel 可能是最有效的。
韋姆克博士報告說,試驗中的所有參與者都出現了治療引起的副作用。然而,大多數情況並不危險,主要是由輸注 lifileucel 之前進行的化療和之後給予的 IL-2 引起的。最常見的症狀包括貧血、高燒以及血小板和某些白血球水平大幅下降。
Wermke 博士說,TIL 療法似乎不會引起接受 CAR T 細胞療法的患者中常見的嚴重免疫相關副作用,包括細胞激素釋放症候群和神經系統影響。
Iovance 宣布已批准全美 30 多個治療中心收集腫瘤樣本,用於製造 lifileucel 並對患者進行最終治療。預計到5月底將有50個這樣的中心。
最初,所有治療藥物都將在費城的 Iovance 工廠或承包工廠生產。
該公司稱,使用 lifileucel 進行單次治療將花費 51.5 萬美元。在批准後舉行的公司網路廣播中,Iovance 官員表示,他們預計許多保險公司將按照與 CAR T 細胞療法相同的水平承保該治療,後者的費用也高達數十萬美元。該公司還為患者制定了經濟援助計劃。
約翰霍普金斯大學西德尼金梅爾癌症中心黑色素瘤計畫聯合主任威廉沙夫曼醫學博士表示,這項批准對於晚期黑色素瘤患者來說是「非常令人興奮」的消息。
但是,Sharfman 博士警告說,在患者中使用 lifileucel「存在一些限制因素」。
他說,其中之一是患者需要相對健康才能接受治療,而對於接受其他治療的晚期癌症患者來說,情況並非總是如此。 「患者確實需要有正常的心肺功能,」他說。
lifileucel 批准後,接下來會發生什麼?
FDA 批准治療黑色素瘤只是 lifileucel 邁出的第一步。 Iovance 已經開始招募參與者參加一項大型試驗,該試驗將 lifileucel 與免疫療法藥物 pembrolizumab (Keytruda) 結合作為晚期黑色素瘤的初始治療。
Lifileucel 在其他癌症治療方面的檢查也進展順利,包括在晚期肺癌、卵巢癌和頭頸癌患者中顯示出有希望的腫瘤反應。
Rosenberg 博士的實驗室和其他人正在臨床試驗中測試基於 TIL 的新型療法,不僅針對黑色素瘤,還針對其他實體癌症。
「有明顯的例子表明 TIL 療法已導致[其他實體]腫瘤消退,」Rosenberg 博士說。這包括徹底根除晚期結腸癌個別患者的腫瘤退出免責聲明以及在 NIH 臨床中心進行臨床試驗治療的 晚期乳癌。
Shoushtari 博士說,有了這項“里程碑式的批准”,人們對 TIL 療法和更廣泛的細胞療法抱持著很大的樂觀態度。 「我預計這項[批准]將只是基於細胞的實體瘤免疫療法的冰山一角,」他補充道。
他說,像 lifileucel 這樣的第一代 TIL 是這些治療方法非常有效的「重要進步和概念證明」。 “但要擴大其用途,無論是針對其他癌症類型還是更廣泛的黑色素瘤患者,還有很多工作要做。”
沙夫曼博士同意了。 “這就是挑戰:設計更好的 TIL。”
研究人員已經開始應對這項挑戰,包括尋找方法來製造更有效的 TIL,並可用於更廣泛的實體腫瘤。例如,NCI 的 Rosenberg 博士團隊開發了一種識別 TIL 的方法,這種 TIL 能夠強烈識別腫瘤並最有可能攻擊腫瘤。
研究人員也開始對 TIL 進行基因工程,目的是增加對治療有反應的人數,或消除輸注前化療或輸注後 IL-2 的需要。
羅森伯格博士強調,他和其他團隊數十年來對癌細胞療法的研究為快速進展鋪平了道路。














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)










