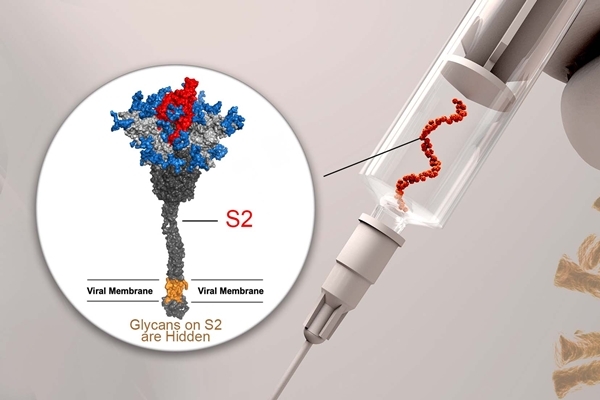
研究團隊以先前發展廣效疫苗的策略,透過小鼠實驗,發現接種去醣化棘突蛋白能誘導廣泛的保護性抗體及T細胞免疫反應,並可以對抗新型冠狀病毒及其變異株。從接種去醣化棘突蛋白的小鼠中也分離出一廣效單株抗體可辨識棘突蛋白上受體結合區(receptor binding domain)中不易突變的區域,進而中和不同變異株;而接種正常(全醣化)棘突蛋白並無法誘導此種抗體。
本次研究,吳俊毅博士後研究員利用RNA疫苗技術將棘突蛋白上受體結合區或S2區域上的醣化點位移除後,在小鼠實驗中所引發的抗體可以提高5-8倍的保護力來對抗各式變異株如Alpha、Beta、Gamma、Delta及最近大流行的Omicron變異株等(圖一)。另一博士後研究員鄭成偉(現高醫大助理教授)藉由分析600萬筆新冠病毒棘突蛋白序列後,發現棘突蛋白上24個醣化位置都沒有改變,並發現有12段不易突變的胜肽抗原分別位於受體結合區及S2區域上,且其中有10段抗原被醣分子遮蓋,因此移除受體結合區上4個或S2區域上的9個醣化點位使更多不易突變且被醣分子遮蔽的抗原能被免疫系統辨識,進而誘發可對抗不同變異株的免疫反應。
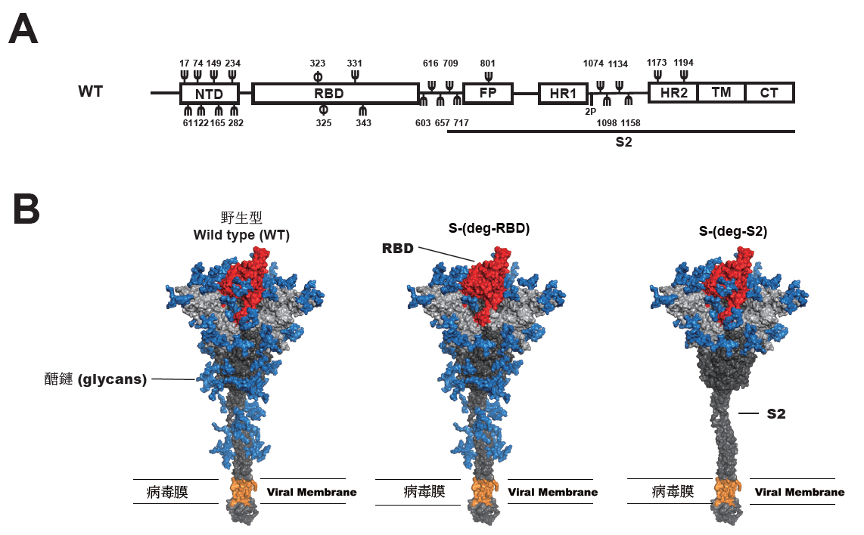
A:新冠肺炎病毒棘突蛋白結構示意圖。Ψ, N-醣基化點位; φ, O-醣基化點位。B:廣效新冠肺炎RNA疫苗設計示意圖。
除此之外,本研究還發現,棘突蛋白上的醣化會影響蛋白質折疊和T細胞反應。在這項研究特別重要的發現是,去除S2區域中的醣化點位會導致表現出的棘突蛋白沒辦法折疊成正確的三度結構,而這結構錯誤的棘突蛋白可提高約3倍的CD8+ T 細胞免疫反應及促使樹狀細胞(dendritic cells)提高第一類主要組織相容性複合體(major histocompatibility complex class I)的表現來增加RNA疫苗的廣效性。
根據這個研究結果,去除不易突變區域的醣分子可以暴露更多不易突變的共同抗原,進而誘導更廣泛和更強的免疫反應。這個成功研製出全球第一隻去醣化新型冠狀病毒RNA疫苗的研究,不僅提供了針對新型冠狀病毒及其關注變異株的廣效疫苗,也為其他RNA疫苗的開發提供了新的策略。
研究團隊表示:利用去除特定點位的醣化而造成蛋白摺疊錯誤及不穩定性來誘發並提升T細胞免疫反應是首次發現。團隊更進一步指出:許多去醣化的蛋白質因以上因素往往無法生產並加以純化以供研究,但藉由RNA疫苗的技術,讓去醣化的蛋白質直接在細胞內表現,可以克服此困難。因此本次發現堪稱為疫苗研發的重大里程碑
本研究的第一作者為吳俊毅博士(基因體中心博士後研究員),其他研究成員為鄭成偉博士(現高雄醫學大學助理教授)、龔治銓、廖國翔博士、詹家琮技師、馬徹教授及翁啟惠院士。
本論文發表於《美國國家科學院院刊》(PNAS),論文連結: https://www.pnas.org/content/119/9/e2119995119?fbclid=IwAR1FS8MUkyPS20D8sBfq5_NbjBT9M2ZAJBU_0uXKEL72mSBuojCT2-3STyQ。經費來源:生醫轉譯及新藥研發計畫。














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)