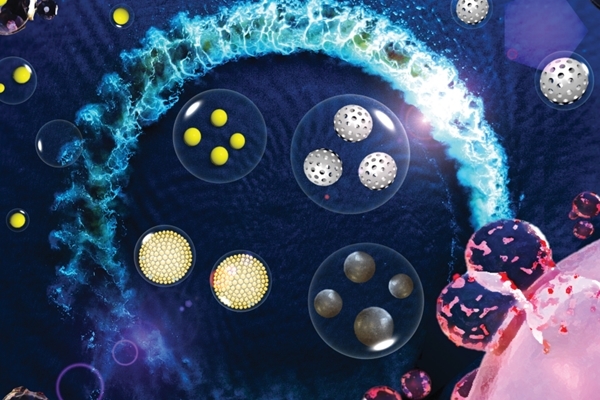
中研院基因體研究中心蕭宏昇教授領軍的研究團隊彙整近五年重點文獻並於Nanoscale Horizons期刊發表一篇學術回顧論文(review article),旨在探討多樣化的奈米材料與外泌體結合後在生物醫學領域應用的情形,並闡述這種新型材料正如巨大浪潮般席捲了整個臨床醫學領域,並獲選為該期刊之Inside front cover。
簡單來說,外泌體是細胞外囊泡 (extracellular vesicles) 的一種,其脂質雙層膜囊泡內會攜帶核酸、蛋白質、醣類、脂質等多種訊號因子。細胞通過細胞膜內陷後會形成內體,內體不斷形成細胞內多囊泡體,當多囊泡體外膜與細胞膜融合,即被細胞分泌到胞外就會形成外泌體。正因外泌體特有的生物相容性以及可攜帶不同類型的內含物,使其可應用成為診斷型外泌體(diagnostic exosomes, dExos)與治療型外泌體(therapeutic exosomes, tExos),特別是當治療型外泌體被設計成可包裹獨特生物活性分子,如:腫瘤抑制分子或化療藥物,非常有機會發展為具靶向配體之癌症治療劑。此外,因其可開發成穿透血腦屏障之多功能藥物系統,外泌體被認作是目前膠質母細胞瘤(glioblastoma, GBM),亦為腦瘤末期的絕佳診療候選者。
前景看好的外泌體,要能真正作為醫療體系的抗癌平台,仍有許多課題等待釐清。其中,最重要的莫過於治療劑量的優化設計與對外泌體微脂粒之追蹤診斷。
單純使用外泌體當作載體來攜帶基因或蛋白質,須投入每毫升大於1010個顆粒之劑量才有治療效果。現有文獻指出,採用無機/有機奈米材料作為載體,僅需10ng每毫升的藥物即可產生相同的治療效果,相當於減少1000倍外泌體的顆粒消耗量。加上無機/有機奈米材料本身具備各種追蹤診斷的特性,可以用來標定外泌體的位置,例如添加磁性奈米材料在外泌體中,就可以透過磁共振造影(Magnetic Resonance Imaging, MRI)來追蹤外泌體的移動過程。此外,複合無機/有機奈米材料還能使多功能外泌體具備控制藥物劑量的能力,進一步為病人的安全把關。
本篇論文也邀請兩位國內外學者一同針對該主題提出關鍵見解。美國俄亥俄州立大學化學與生物分子工程學系李利教授的研究團隊開發出一種可檢測液態生物檢體 (liquid biopsy)的奈米晶片,名為「組織奈米轉染」(Tissue Nano Transfection, TNT)。該裝置可用來觀察腫瘤細胞所釋放出外泌體顆粒中的RNA分子,透過該技術就能早期發現癌症徵兆,提升癌症篩檢的正確率。李教授表示,複合無機/有機奈米材料之外泌體能夠大幅改善對外泌體的即時追蹤,使醫生能時掌握外泌體的動態變化。國立陽明交通大學生物藥學研究所與臨床醫學研究所黃奇英教授則表示多功能外泌體是現今臨床不可或缺的治療診斷平台。外泌體所具有的高度生物相容性以及藥物攜帶能力,已經通過美國食品藥品監督管理局(Food and Drug Administration, FDA)的二期測試,被認為是未來臨床應用的新標竿。由此可見,外泌體診斷與治療的功效已在多項研究工作中得到驗證。
然而,與大多數藥物在臨床應用所面臨的問題一樣,奈米材料的生物評估(Biological evaluation)仍需要更多的科學數據來佐證。即使有機/無機奈米粒子嵌合外泌體展現出色的治療和診斷潛力,其複雜性仍須待研究人員在安全性與生物相容性等層面上注入更多心力,同時也需要對其生物降解性、毒性等進行評估,確保無機/有機物質不會長期累積在體內造成傷害。再者,外泌體無法在體外環境合成,樣本製成有一定程度的困難性,必須先將無機/有機奈米材料送入細胞,收集並純化分泌出來的複合外泌體,接著才能進行後續的應用。
論文第一作者詹明賢博士與共同第一作者張芷瑄同學則表示,撰寫這篇綜述文章最初的目的,在於彙整出一個能夠兼具診斷和治療的多功能外泌體藥物平台。當有機/無機奈米粒子嵌合外泌體後,可以在生物醫療領域內提供靶向追蹤、改善血液分散性與避免免疫系統清除等優勢。現今,個人化精準醫療日趨重要,可從病人個體內直接取出專一化的外泌體便是該研究極富潛力的關鍵。
總觀以上論述不難發現,現今想要找到創新的方法來解決問題,跨領域的相互合作已是不二法門。蕭教授也透露不畫地自限、勇於嘗試新事物是他在研究這條道路上的精神指引。出身病理學領域專業的蕭教授,其研究團隊在奈米材料與複合性醫療方面也繳出了亮眼的成績單(新聞:面面俱到 新型奈米材料FePt@MMT開創複合性醫療用途 / 螢光奈米粒子導航,小鼠肺癌早期治療與轉移偵測)。我們誠摯地歡迎來自不同領域如:生物、化學、醫學、材料等背景的莘莘學子與專業人才共同投入,讓多功能奈米粒子嵌合外泌體的癌症治療診斷平台萌芽、扎根,為個人化精準治療與診斷開創新的視野。
論文全文< Integrated therapy platform of exosomal system: hybrid inorganic/organic nanoparticles with exosomes for cancer treatment>,詳見:https://pubs.rsc.org/en/content/articlelanding/2022/nh/d1nh00637a
期刊封面:https://pubs.rsc.org/en/content/articlelanding/2022/nh/d2nh90012b














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)