基因體研究中心李文華院士和助研究員胡春美的團隊長期致力於胰臟癌研究,近日發表的成果證實,癌細胞的生成和轉移,除了癌細胞本身的特性之外,也與癌細胞所處的周遭環境有關。胰臟癌細胞藉著與周遭基質細胞進行細胞膜之間的直接接觸,從而「教育」隸屬基質細胞一員的纖維母細胞 (fibroblasts),將其吸收成為癌細胞的幫手,協助打造更適合癌細胞增殖的微環境。而阻斷癌細胞與纖維母細胞的接觸,則可望成為治療胰臟癌的新策略。這項成果發表在最新一期的Nature Communications期刊。
癌細胞外圍不僅有癌細胞、還有許多正常的原組織細胞、纖維母細胞、免疫細胞和血管等等,構成一個複雜的微環境。最常見的胰臟癌為胰腺癌 (Pancreatic ductal adenocarcinoma, PDAC),胰腺癌細胞的特徵,就是以纖維母細胞為主要細胞成分構成微環境。
本篇論文第一作者博士後研究員陳以瑛表示,「我們在檢視胰臟癌病患的檢體時,看到一個現象,當大量活化的纖維母細胞與癌細胞緊密相連時,病人的惡性程度增加,不僅六個月內原位復發以及遠端轉移的機率較高,存活率也大幅下降。」
研究人員進行細胞實驗:將癌細胞與纖維母細胞直接培養在一起,可以增加癌細胞之癌症幹細胞的特性,更可以增加其轉移侵襲的能力。進一步探究其機制,將兩種細胞培養在一起,發現當纖維母細胞往癌細胞靠近並直接接觸後,沿著兩種細胞接觸的邊界,有一種名為Activin A的生長激素,會從纖維母細胞被大量的釋放出來。此生長激素會增加癌細胞上皮-間質轉化(epithelial–mesenchymal transition, EMT)的特性,加速癌細胞的轉移,除此之外,Activin也會更加活化纖維母細胞,使其利於癌細胞生長。
在胰腺癌病人的臨床樣本中,我們發現當癌細胞周圍的纖維母細胞Activin A mRNA表現量愈高,病患的癌症愈加惡性重大。促使纖維母細胞「黑化」的關鍵因子可在癌細胞上的ATP1A1蛋白質表現量窺見一二。「若是癌細胞膜上的ATP1A1蛋白質表現越高,周圍纖維母細胞Activin A的表現量也越高」。
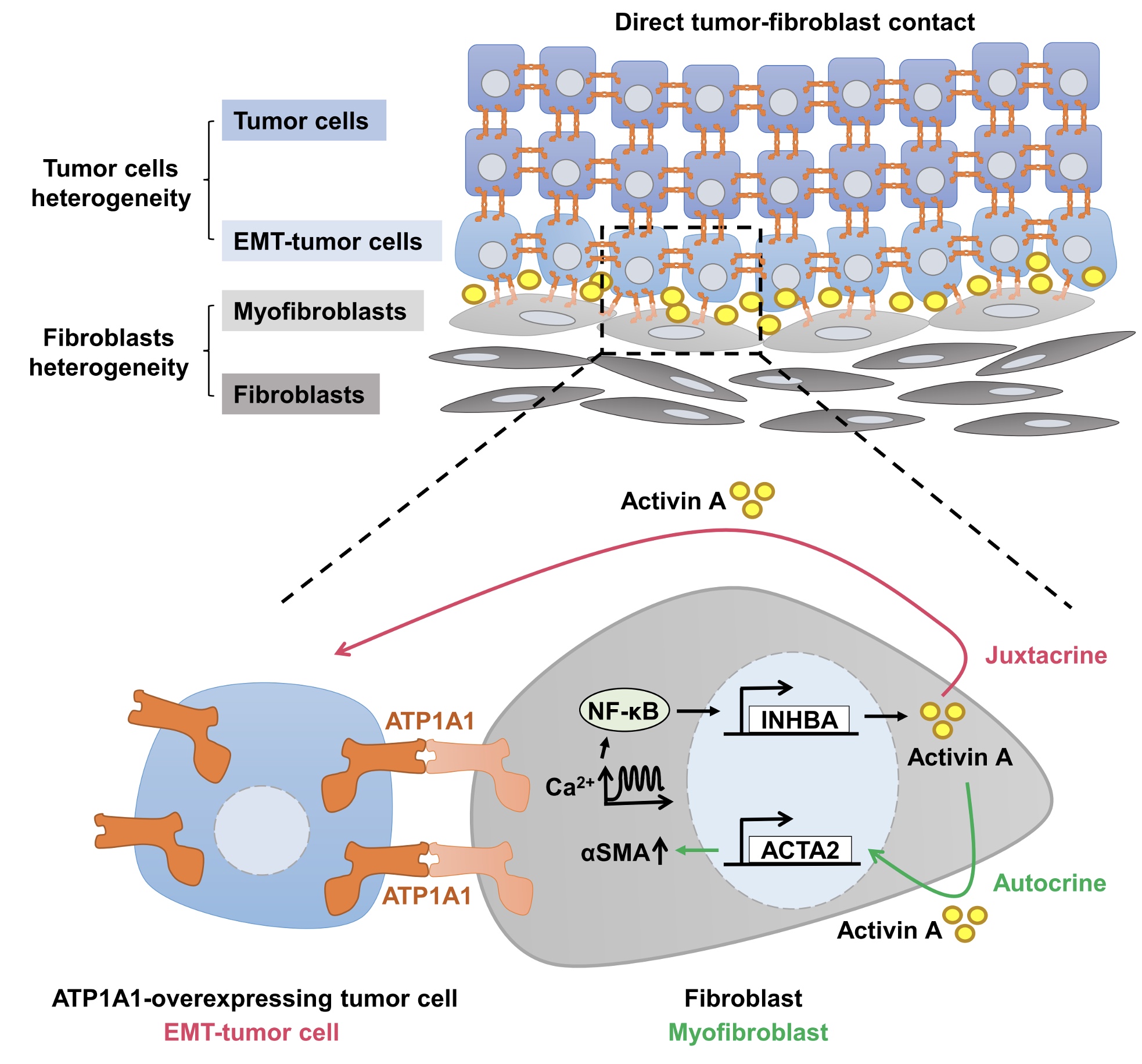 |
| ATP1A1過度表現的癌細胞,與周圍纖維母細胞以ATP1A1連結,並誘導纖維母細胞分泌Activin A,增加癌細胞上皮-間質轉化(EMT)的特性及纖維母細胞活化,促進腫瘤侵犯及轉移。 |
研究指出,胰臟癌細胞利用細胞膜上的ATP1A1蛋白質,如同觸角般尋找附近擁有同樣特徵的正常細胞。即使周遭的纖維母細胞內部只有微量的ATP1A1,但是只要癌細胞靠近,ATP1A1就會聚集到兩個細胞交界的區域。「癌細胞找到同樣擁有ATP1A1的纖維母細胞,就會以ATP1A1當作橋梁,讓兩個細胞直接連結在一起,此連結會促使纖維母細胞釋放Activin A,進而增進癌細胞的轉移特性,並且活化纖維母細胞,」陳博士說明。
原本纖維母細胞是生物結締組織的結構,主要負責組織的修復與重塑。腫瘤初始,微環境裡的纖維母細胞對於腫瘤生成並不友善,做為組織的支撐結構,它的剛直特性阻礙了新血管的生成,會抑制腫瘤快速成長。
但是,一旦纖維母細胞被靠近的癌細胞「教育」,讓原本限制癌細胞生長的阻力換邊站,不但釋放生長激素增生血管,給癌細胞運送氧氣和養分等物資,而且癌細胞藉由ATP1A1與纖維母細胞結合,增加兩者之間的黏著性,並幫助癌細胞塑型成圓滑的體型,有利於移動至血管,然後轉移到其他器官。
研究團隊不僅在癌細胞周邊,發現有許多癌細胞與纖維母細胞聚集在一起的團簇,也在血液裡找到兩個細胞結合成團的蹤跡,顯示它們已經進入循環,有可能移居到其它器官。可以說癌細胞從周圍吸收到助手,共同將週遭環境打造成最有利的生長條件,更趁機坐大,向外侵略擴展造成轉移。
胰臟癌惡化速度快,預後也最差,藥物與手術治療的效果有限,研究團隊對於該研究所發現的機制,衍伸到阻斷癌細胞和纖維母細胞之間的作用,或是抑制Activin A的分泌等,都可作為日後胰臟癌治療的新策略,若能切斷癌症轉移的路徑,就看得到治癒的曙光。 本次研究在團隊通力合作下完成,參與成員有中央研究院李文華院士;基因體研究中心胡春美助研究員和陳以瑛博士;另外感謝臺大醫院田郁文醫師、張毓廷醫師、章明珠醫師和鄭永銘醫師提供協助。
論文全文『Homophilic ATP1A1 Binding Induces Activin A Secretion to Promote EMT of Tumor Cells and Myofibroblast Activation』。網址:https://doi.org/10.1038/s41467-022-30638-4。
資料來源: 中央研究院基因體研究中心














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)