本院細生所高承福與國立臺灣大學食科所羅翊禎實驗室團隊透過酵母菌發現高強度轉錄的基因上的組蛋白H3的甲基化修飾(H3K4me)可以抑制在DNA複製壓力下因TRC所造成的基因突變。此研究成果不僅為困擾學界多年的「H3K4me功能之謎」增添了一塊重要拼圖,同時解釋了臨床上的人類細胞在缺乏H3K4me會演變成癌細胞的可能原因。此論文已於今(2020)年2月10日刊登於國際期刊《自然通訊》(Nature Communications)。
目前學界已知細胞在面對TRC當下,必須有效率地放棄轉錄活動,以“讓道”DNA複製體順利通過,避免複製體停滯造成DNA結構上的崩塌。但是,在轉錄活動極旺盛的基因上,此“讓道”機制有可能不足以充分調解源源不絕轉錄活動,造成劇烈的TRC,因此導致相較一般基因區域有著更高的突變風險。TRC在原核細胞中頻繁發生,係促進細菌演化與逆境適應的機制之一。在真核生物細胞內,因TRC造成的基因突變並不如原核細胞般頻繁,然而詳細的機制至今未解。典型的H3K4me標記在基因組上的組蛋白,其含量從基因的起始端至末端呈現高至低的漸層,此一現象一直以來被認為與轉錄調控及轉錄記憶有關。然而事實上,這修飾標記會隨著轉錄活動而被持續疊加在基因組上,明顯是基因表現的副產品,所以其確實功能為何迄今都未有統一且圓滿的解釋。
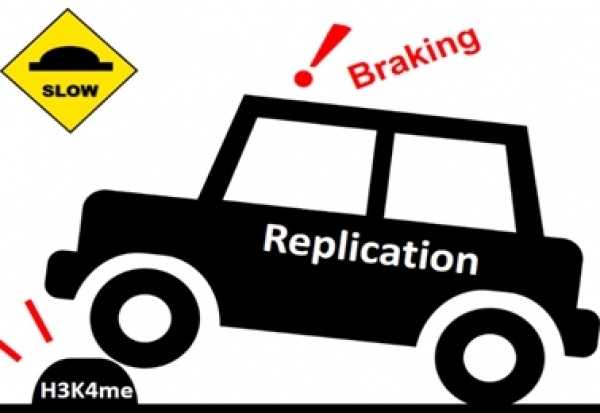
研究團隊首先發現酵母菌細胞在失去H3K4me後,DNA複製體前進的速率有變快的現象。研究團隊因此提出了「減速丘模型」來描述所觀察的現象。顧名思義,「減速丘」係意指H3K4上的甲基化修飾,會對穩定前進的複製體帶來減速效果,但對不穩定的複製體則會帶來致命的後果,猶如性能正常的車子能減並速穩定地通過減速丘,而剎車失靈或失控中的車子則會衝撞減速丘導致悲劇發生。
為何真核細胞內需要這類「減速丘」來減緩複製體前進?團隊的進一步研究發現這一切是真核細胞中的精巧設計!由於H3K4me這「減速丘」會隨著轉錄的次數累積在基因的組蛋白上,意味著越是活躍的基因上會被設置了越多的「減速丘」。當「車子」(複製體)通過轉錄活性活躍的區域,會因為這些「減速丘」而慢下來,進而緩解了與轉錄組在相同DNA片段上的衝突,減少模板的損傷並降低基因突變的機率。這個假說已經透過實驗驗證,團隊發現當細胞面對DNA複製壓力時,活躍的基因發生突變的機率會因為「減速丘」的存在而降低,而相對不活躍的基因之突變率則不會因「減速丘」的存在與否而有改變,顯示細胞在轉錄過程中,尤其是在高度活躍的轉錄區域,設置「減速丘」像是為了對準備通過的複製體「警示」說:“前面有大量轉錄體,請減速避免意外”。
本研究在「為何轉錄體要在基因上標記H3K4me」的謎題上提供了一個合理且生動的解釋,未來將朝著H3K4me是如何形成「減速丘」的分子機制做進一步探討。本文第一作者張舜延為臺大食科所博士生,由中研院細生所高承福副研究員、台大食科所羅翊禎教授共同指導。本研究團隊包括臺大醫學院生化分生所林敬哲教授、中研院資訊所蔡懷寬研究員與蔡政宏、美國Fred Hutchinson Cancer Research Center的Sue Biggins研究員、Toshio Tsukiyama研究員與Sam Cutler博士。研究經費來源來自臺大/中研院聯合辦公室、中研院、科技部,美國國家衛生研究院(NIH)與霍華德·休斯醫學研究所(HHMI)。














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)