中研院基因體中心特聘研究員李文華團隊分別與台大醫院神經部蔡力凱主治醫師、台北醫學大學陳凱筠副教授、中研院生物醫學科學研究所施修明研究員,以及中國醫學大學徐婕琳助理教授及中國醫藥大學附設醫院消化系胃腸科周仁偉主任、內科講座教授及風濕免疫科藍忠亮醫生和吳柏樟主治醫師的合作研究發現,抗氧化酵素穀胱甘肽(GPx)家族的兩個成員(GPx7和GPx8),雖不具酵素活性,卻可以做為活性氧類感測器,調控氧化壓力來避免運動神經元和發炎性腸道疾病的產生,並透過相關機制的抑制劑,作為治療疾病的藥物。
其中抗氧化穀胱甘肽酶7 (GPx7, 或稱NPGPx),則是抑制運動神經元內蛋白質去醣化的反應,來對抗氧化壓力,缺乏則會出現運動神經元萎縮退化、下肢癱瘓等病徵,與漸凍症十分相似。而抗氧化穀胱甘肽酶8 (GPx8),則是抑制了巨噬細胞內活性氧類所影響的發炎反應,保護腸道免於細菌引起之結腸炎及慢性發炎可導致之大腸癌等疾病。
大腦和脊髓神經元對於活性氧類特別敏感,所以一直以來,氧化壓力被認為是許多神經退化性疾病的罪魁禍首。穀胱甘肽酶7 (GPx7)研究主要由李文華院士實驗室謝咏霖博士及陽明大學生化所博士生蘇芳儀兩位進行,他們觀察到穀胱甘肽酶7(GPx7)基因剔除鼠出現運動神經元退化,甚至有部分小鼠出現嚴重下肢癱瘓及無法正常站立,首先聯想到的就是漸凍症。進一步與台大醫院神經部蔡力凱主治醫師以及台北醫學大學陳凱筠副教授的合作之下,團隊觀察到漸凍症病人的穀胱甘肽酶7 (GPx7)表現量明顯低於一般人。
利用穀胱甘肽酶7 (GPx7)基因剔除鼠進行研究,發現小鼠成長到11個月大時(相當於人類的中年),每隻小鼠的行動力都減弱,其中約有10%小鼠發展出嚴重的後肢癱瘓,並隨著時間的推移,症狀更加嚴重。相較於一般小鼠平均2-3年的生命週期,運動神經元退化的病鼠會提早在15個月後就逐漸死亡。將病鼠的脊髓組織進行免疫螢光染色分析,發現他們的運動神經元數量相較於同齡正常小鼠大幅減少了約20%,運動神經元連接至肌肉的突觸結構也逐漸凋零退出接合處,顯示運動神經元已經慢慢地失去了控制肌肉的能力。這些結果可以證明,缺乏穀胱甘肽酶7 (GPx7)將會導致脊髓中的運動神經元萎縮凋亡,形成類似漸凍症的病徵。
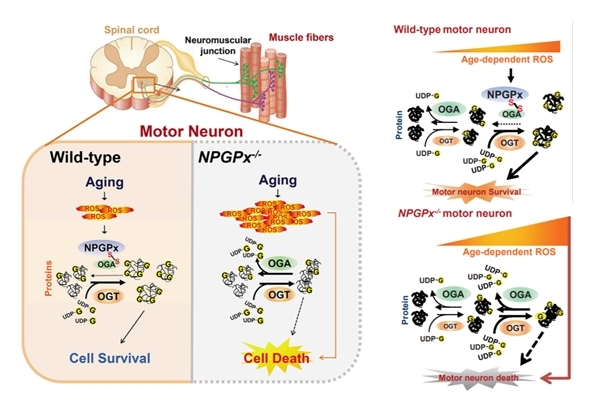
團隊與中心胡春美助研究員合作下發現,穀胱甘肽酶7 (GPx7)可做為氧化壓力的感測蛋白,當細胞感受到過多的活性氧類時,就會啟動O-GlcNAcylation調節機制因應。O-GlcNAcylation是一個將蛋白質加上O 連結乙醯葡萄氨糖(O-GlcNAc)的醣化作用,進而影響蛋白質功能,由兩種酵素協助完成正向與逆向轉換的反應:O 連結乙醯葡萄氨糖轉移酶O-GlcNAc transferase (OGT)協助蛋白質的醣化,而O 連結乙醯葡萄氨糖苷酶O-GlcNAcase (OGA)則是負責移除蛋白質的醣化。在正常的細胞中,兩個酵素相輔相成保持醣化動態平衡,使蛋白質能夠正常作用;然而當醣化調節機制失衡時,容易導致蛋白質的功能異常及堆疊。
這個研究顯示,作為氧化壓力感測和傳導因子的穀胱甘肽酶7 (GPx7),其功能就是釋放訊息給OGA,並且與OGA結合,抑制蛋白質去醣化的反應。病鼠由於缺乏GPx7這個調控因子,無法抑制OGA對醣化的逆向反應,使正向醣化反應無法上調、緩解增加的氧化壓力,因壓力而受傷的運動神經元細胞只能走向凋亡之途。
研究團隊利用一種稱為Thiamet-G (TMG)的OGA抑制劑,將9個月大的基因剔除鼠持續餵食TMG藥劑3個月後,發現小鼠體內的醣化反應上升了,運動神經元數量不會減退,運動神經元連接至肌肉的突觸結構也不再退化,運動能力明顯變好。
有鑑於神經退化性疾病是一個緩慢的病變過程,研究團隊這次以長期觀察的方式,引進老化這個因子,建立起年齡、氧化壓力、醣化調節機制三者互相牽動的動物模型,希望能模擬人體實際運作的方式,找到漸凍症致病機制和治療的策略。
在李文華研究團隊中負責抗氧化穀胱甘肽酶8 (GPx8)研究的徐婕琳,也是中國醫藥大學助理教授,她表示,在觀察基因剃除鼠時發現,老鼠的腸道功能有問題,一項明顯的證據就是:腸道菌叢的豐富性及多樣性降低了,一般認為微生物豐富性是健康狀態的指標:腸道菌失衡與免疫及發炎相關疾病有關。徐婕琳老師在與專門治療發炎性腸道疾病的周仁偉主任,及自體免疫疾病專家藍忠亮講座教授的合作研究中發現,在與許多患有潰瘍性結腸炎病患的檢體進行組織比對之後,發現患者的穀胱甘肽酶8 (GPx8)基因表現果然偏低,顯示此一基因的缺乏與結腸炎存在著密切關係。
徐婕琳老師表示,人體腸道內有很多細菌,若被免疫系統視為病原體入侵,免疫系統中巨噬細胞會產生活性氧類,同時還被細菌誘導活化caspase-4及發炎體。發炎體除了識別各類病原體以及危險信號外,也可進一步產生細胞激素,這就是發炎反應。這一連串的發炎反應都是為了號召其他部位的免疫細胞前來支援,儲備對抗病原體下一波攻擊的戰力。研究發現缺少穀胱甘肽酶8 (GPx8),就會對自由基的感測失靈,無法使caspase-4活化煞車,而使得發炎反應停不下來,腸道持續的慢性發炎就是結腸炎、克隆氏症及大腸癌等疾病的肇因。
免疫系統是一套設計精巧的防禦系統,設定層層關卡,每一層都有啟動裝置,也設定了煞車點,為了免於自傷,務求戰場越小越好,戰勝速度越快越好。研究團隊發現細胞利用穀胱甘肽酶8 (GPx8)當作感測器設定煞車點,並針對兩種藥物進行測試,檢測能否抑制這條免疫發炎路徑的過度反應:一是利用小分子藥物來去除過多的自由基:一個則是運用抑制劑來抑制caspase-4蛋白質的活化。發現兩種藥物都可以抑制過度發炎反應,這些抑制劑都是將來可成為治療自體免疫及腸道發炎疾病像是克隆氏症的潛在藥物。
腸胃不好、神經退化都是老化的象徵,顯示細胞抗氧化力減退,不敵氧化壓力的侵襲。生物體中的抗氧化穀胱甘肽(GPx)酵素是為了抵抗活性氧類而存在,能迅速將體內所產生的活性氧類透過氧化還原的方式代謝成毒性較小或無毒的物質。同時參與這兩項研究的胡春美老師表示,本次的研究中以穀胱甘肽7和8 (GPx7 and GPx8)酵素調控氧化壓力作為主軸,希望能藉此平衡多餘的活性氧類,達成體內免疫防禦系統與抗氧化兩大系統的平衡,維持健康最佳狀態。
這兩個研究相關的論文可以於線上查閱:
有關GPx7 的研究,於Cell Reports 期刊網站: https://www.cell.com/cell-reports/pdf/S2211-1247(19)31367-1.pdf
有關GPx8 的研究,於EMBO Molecular Medicine網站:https://www.embopress.org/doi/epdf/10.15252/emmm.201809386














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)