由於醫療科技的日新月異,乳癌的平均五年存活率已高達90%,但是,轉移復發仍舊是患者的噩夢,一旦發生轉移,五年存活率從90%陡降到30%。因此,目前乳癌治療的重點,除了針對原發性腫瘤外,更重要的是得想辦法不讓癌細胞轉移。
黃雯華表示,最初在分析乳癌轉移的基因數據時,發現負責細胞黏附的DSG2,在乳癌轉移的病人檢體中中有異常高的表現量。團隊進一步檢視來自台大醫院病理科鄭永銘教授所提供的乳癌病患檢體切片,發現病患中,其乳癌細胞具有DSG2表現者,存活率明顯較低,而且復發率也較高。同樣的現象,也發生在以國外患者為族群的基因研究中,而且這個現象不限於某類乳癌。數據的分析與臨床產生連結,開啟了研究的契機。
研究團隊建立兩種小鼠動物實驗模型,他們將乳癌細胞植入小鼠的乳腺脂肪袋內,讓癌細胞在老鼠體內生長。結果發現,在這些小鼠體內,具有DSG2基因高表現的乳癌細胞、相較於DSG2低表現的乳癌細胞,其原位腫瘤大小、血液中的循環腫瘤細胞(CTC)、以及轉移到肺臟的癌細胞都出現顯著的增加。
循環腫瘤細胞(CTC),是從原發腫瘤中脫落的單顆或多顆癌細胞,這些癌細胞會隨著血液的流動,尋找到適合定居的其他器官組織,生長形成新的腫瘤,造成癌症的轉移。
「引起我們注意的是,老鼠血液中的循環腫瘤細胞(CTC)產生群聚移動的情況變多了。」黃雯華解釋,近年來的研究,血液中移動的腫瘤細胞不僅以單細胞方式移動,有些會形成團聚,成群結隊的移動。比起單打獨鬥,群聚移動的癌細胞,更能夠在循環系統內存活下來,並在其他組織落地生根。
「我們發現,DSG2的表現與血液中的CTC群聚情況呈正比;而且正因為DSG2掌管細胞的黏附,讓癌細胞轉移到新地方的定居具備更多的優勢。」黃雯華說明。
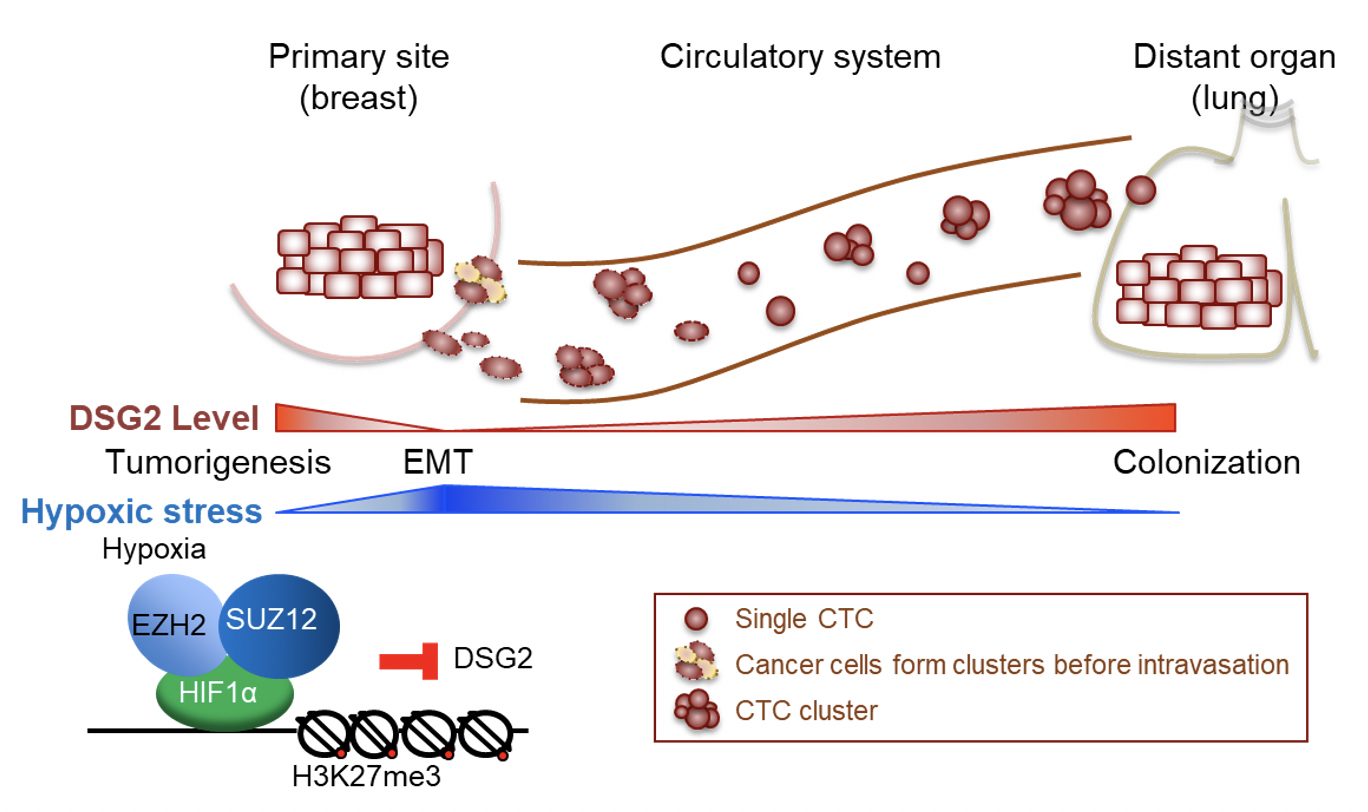
除此之外,DSG2之所以讓研究人員驚豔,在於DSG2的表現量是動態的。研究團隊的實驗數據描繪出癌細胞生長轉移過程中,DSG2因應微環境所產生的變動而變化。
 |
| DSG2在癌細胞生長轉移過程中的動態轉換 |
研究指出,DSG2會讓腫瘤細胞集結成團,促使腫瘤細胞快速成長。一旦腫瘤細胞大量生長在原生區域,會造成部分腫瘤內微環境的缺氧,這時厭氧關鍵調節蛋白HIF-1α出手抑制DSG2的基因表達。少了DSG2,細胞之間的黏附力降低了,腫瘤細胞如同脫韁野馬,趁機脫隊進入循環系統。
轉移並非想像中的容易,大部分循環腫瘤細胞都會在循環系統中死亡。在血液中的氧氣濃度比原生腫瘤中的缺氧區域高,而進入血液中的腫瘤細胞,其DSG2表現量再度回升,協助落單的腫瘤細胞在血液中存活,漂流到其他器官再協助附著定居。無論是原生腫瘤的壯大、血液中的抱團取暖,或是新環境的殖民定居,DSG2都是推手,而DSG2表現量高低會受到微環境中的氧氣濃度而有所變化。
在癌症研究領域中,一般認為厭氧關鍵調節蛋白HIF-1α的轉錄激活功能是促使癌症轉移的關鍵,文獻中尚未見到它以抑制致癌因子的基因表達來驅動癌症的發展。黃雯華表示,「我們的研究是該領域中第一個發現HIF-1α能抑制促癌基因的表現量,也是科學界第一次證實,DSG2的動態改變,對於乳癌的生成與轉移很重要。」
DSG2的多寡與轉移進程息息相關,研究團隊對於用DSG2來當作乳癌診斷的生物標記表示有信心。事實上,除了乳癌之外,DSG2也與子宮頸癌、頭頸癌和肺癌等其他癌症的預後不良相關。DSG2在惡性腫瘤中普遍可見,藉由分析血液中癌細胞DSG2的表現,可以當作是治療方法是否奏效的參考,也可以做為預後的指標。除此之外,以DSG2為治療標靶進行藥物開發研究看起來很有希望。使用單克隆DSG2特異性抗體靶向DSG2或許有機會能抑制腫瘤生長。但是,針對DSG2治療策略的開發,必須考量DSG2在癌症轉移過程不同階段中的表現量及功能。
根據衛福部最新公布的107年癌症統計,乳癌再度蟬聯女性癌症發生率第1位。找出乳癌生成與遠端轉移的原因,進而抑制乳癌的轉移,是科學研究者的共同目標,黃雯華研究團隊向前又邁進了一步。
本研究由中研院及科技部支持,通訊作者為本院基因體研究中心黃雯華助研究員,第一作者為張博皓博士後研究人員。其他參與者包含:陳吟詩(協助研究)、陳銘哲、蔡亞萍(提供DSG2抗體);台大醫院病理科鄭永銘醫師、臺北榮總乳房醫學中心蔡宜芳醫師與臺北榮民總醫院腫瘤醫學部楊慕華醫師(提供乳癌檢體),以及國立臺灣海洋大學生科系許邦弘副教授(蛋白質譜分析)。
論文全文〈Interplay between desmoglein2 and hypoxia controls metastasis in breast cancer〉詳見:https://www.pnas.org/content/118/3/e2014408118。














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)