由中研院基因體中心翁啟惠前院長及馬徹研究員領軍的一個研究顯示,目前幾乎所有COVID-19疫苗所使用的抗原,皆以棘突蛋白為目標,其表面醣基化程度很高,聚醣覆蓋的抗原較少突變,其所能誘發的免疫反應極具開發潛力。研究團隊設計研發單醣化棘突蛋白(monoglycosylated spike)疫苗,可以更完整地針對棘突蛋白質序列中所有可能的抗原表位,引發更強的免疫反應,並提供更好的保護,以防止感染相關變異株。團隊實驗證實,使用單醣化疫苗,對於正在台灣肆虐的英國株變種(B.1.1.7),產生中和抗體的濃度比現行疫苗多了2.7倍,對D614G及南非變種也有更好的保護效果。
SARS-CoV-2 病毒的棘突蛋白與人體細胞的ACE2受體結合後,進入人體引發嚴重特殊傳染性肺炎,也就是新冠肺炎。目前所施打的疫苗,大多是藉由棘突蛋白驅動免疫反應,產生與記憶能抵抗新冠病毒的抗體,增加人體對新冠病毒的免疫力。根據全球共享流感數據倡議組織(GISAID)所收集超過一百萬組的SARS-CoV-2 病毒基因序列分析顯示,在棘突蛋白1,273個氨基酸中有1,000多個位點容易發生突變,具有高度傳播力的英國變種和南非變種也帶有多個突變點位。
病毒棘突蛋白基因位點的累積變異,不但有機會增強病毒的傳染力,還有可能大大影響現行疫苗效力。在施打疫苗後所產生的抗體,必須能夠和病毒緊密結合才有效力,如果病毒發生突變,抗體辨識和中和病毒的能力下降甚至消失,都有可能降低疫苗所能提供的保護力。這也是目前每年流感疫苗必須重製的最大原因,而開發廣效疫苗抗棘突蛋白病毒也是科學研究的終極目標!
應付變種病毒,研究團隊從發展廣效流感疫苗所累積的經驗著手,他們發現棘突蛋白表面醣化的多寡對病毒和抗體的結合力有重大的影響。因為聚醣下面所覆蓋的部分較不容易突變,可以用做抗體辨識變種病毒的特徵;只要把表面多餘的醣剃除,露出更多可供辨認的特徵,能夠讓疫苗產生數量更多且更多樣化的抗體,更有效地對抗新冠病毒及其變種株,達到以不變應萬變的目標。
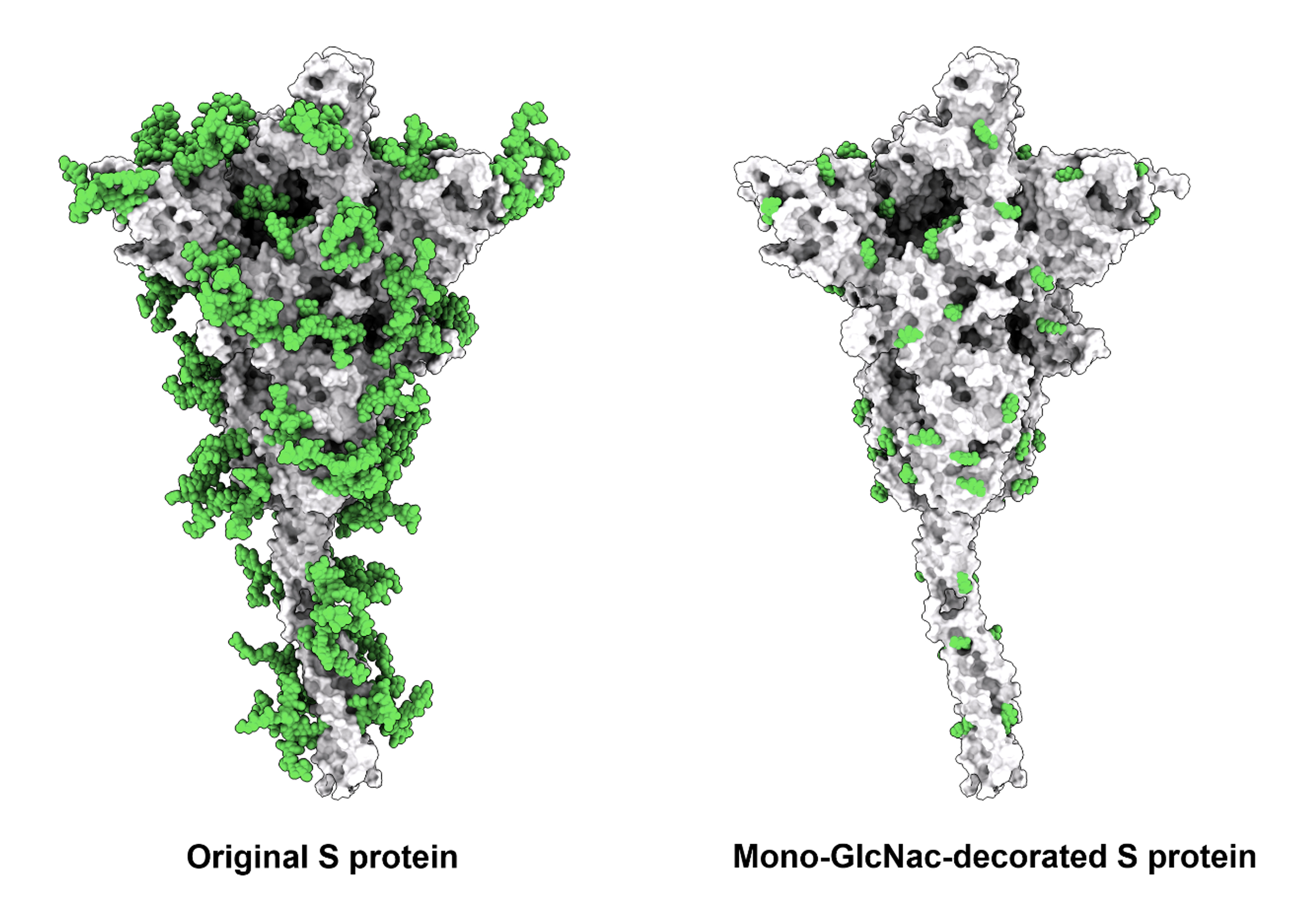
馬徹老師表示,「移除棘突蛋白上多餘的醣,就像是讓病毒脫去偽裝,是發展對抗新冠病毒廣效疫苗最有效的策略。」
依據這樣的理念,馬徹團隊運用專有的醣蛋白工程,移除疫苗棘突蛋白表面會干擾辨識的醣,開發出單醣化棘突蛋白疫苗Smg,並以兩種動物模型驗證這個廣效疫苗的效用:一是以倉鼠模型模擬輕症的患病情境;另一個則是使用替換成人類ACE2受體的基因轉殖鼠(分生所薛一蘋、蔡青宴老師提供),模擬人類受到病毒感染引發成重症的狀態。
在詹家琮老師領軍的P3實驗室,兩個動物模型實驗結果都顯示,比起一般的全醣抗原(Sfg), 單醣棘突蛋白疫苗(Smg)在對抗新冠病毒(非變異株)具有更加好的保護效果。即使感染致死量的SARS-CoV-2病毒,注射了Smg疫苗的hACE2基因轉殖鼠仍具有百分之百的存活率。另外,實驗結果亦發現,相較於一般疫苗,接種Smg廣效疫苗的小鼠,體內所產生的抗體對於病毒親和力較高,中和性抗體濃度也較高,包括原始病毒株、英國株及南非株病毒都有效。其中更值得注意的是,單醣疫苗對抗英國株的表現特別亮眼,所產生的中和抗體濃度是現有疫苗的2.7倍。
本次研究在基因體中心多位老師通力合作下順利完成,參與實驗室包括:翁啟惠老師、馬徹老師、鄭婷仁老師、林國儀老師、詹家琮老師。另外感謝中研院分生所薛一蘋老師和蔡青宴老師、生醫所陳燕輝老師,以及台大醫院張淑媛老師提供協助。本論文第一作者為廖心瑜、黃菡頤、陳曉蕊,持續在本中心從事後續研究工作。
此研究成果已申請美國臨時案專利,並於5月25日於匯集報導SARS-CoV-2最新研究的Preprint線上期刊網站BioRxiv公布。
相關研究論文“Impact of Glycosylation on SARS-CoV-2 Infection and Broadly Protective Vaccine Design”,可於期刊網站查閱:https://www.biorxiv.org/content/10.1101/2021.05.25.445523v1












![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)