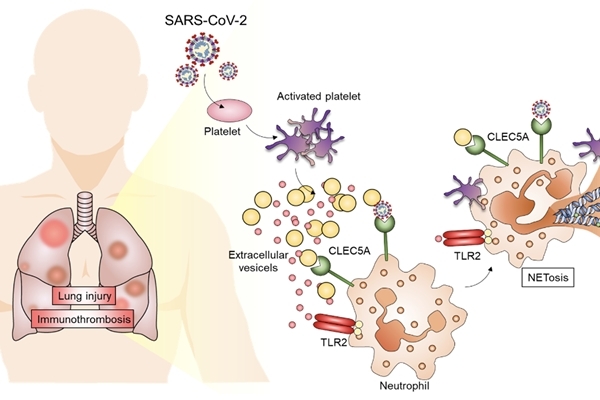
SARS-CoV-2病毒在肺臟裡引起血栓,堵塞微血管的原因,至今尚未有定論。基因體研究中心特聘研究員謝世良實驗室近期發表了一篇研究報告,揭露了COVID-19患者發生血栓的關鍵原因。謝特聘研究員發現SARS-CoV-2病毒會活化血小板以放大發炎反應,進而產生血栓。研究團隊發現,只要阻斷嗜中性白血球表面的兩個受體CLEC5A和TLR2,就可以緩解COVID-19的血栓症狀並且減少血管內凝血以及發炎。這項研究成果已經發表於Journal of Biomedical Science期刊。
住院治療的新冠肺炎中約有40%診斷有急性呼吸窘迫症候群(Acute Respiratory Distress Syndrome, ARDS);ARDS造成肺發炎、組織受損和肺纖維化,其中血栓併發症是COVID-19病人死亡的主要原因之一。
本文第一作者基因體研究中心博士後研究學者宋佩珊博士表示,收集COVID-19急性期患者的血液檢體時發現,血液中含有高量的胞外囊泡(Extracellular vesicles, EV),且這些胞外囊泡大多從血小板而來,顯然與血小板遭遇病毒之後被活化有關。血小板被激活之後,釋放大量地胞外囊體去刺激嗜中性白血球(neutrophil),產生大量的嗜中性白血球胞外捕捉(neutrophil extracellular traps, NETs)及自殺式的細胞死亡(NETosis)。
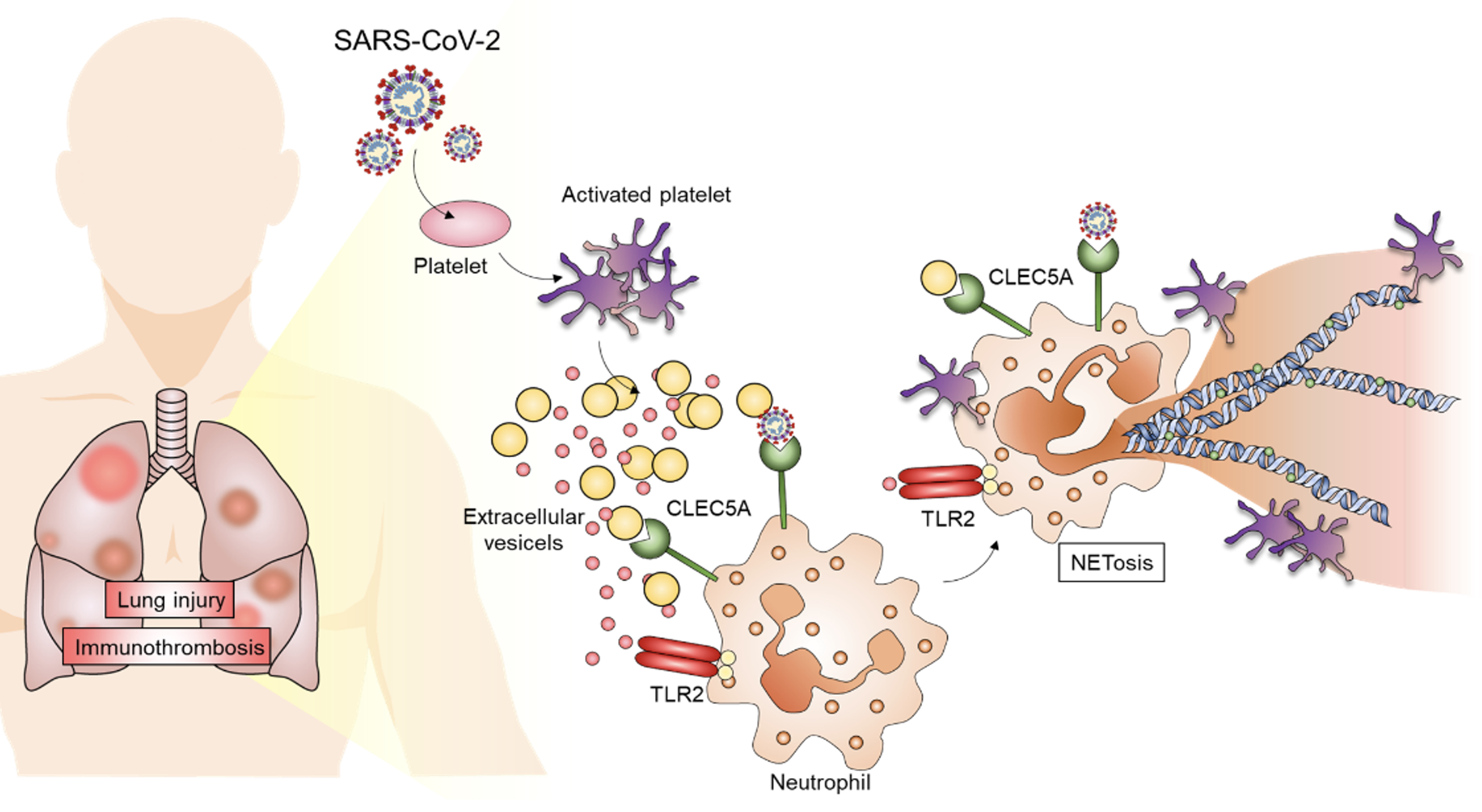 |
| 血小板被激活,觸發NETs形成的免疫細胞訊息傳遞歷程。 |
雖然過去的報導指出NETs形成有助於病菌的清除,但是近期許多COVID-19研究則顯示,病人體內過多的嗜中性胞外網狀結構會引起免疫血栓(immunothrombosis),甚至是嚴重的血管內栓塞,這些肺部微血管阻塞導致肺部及其他器官缺氧,進而造成全身性損害。
過去團隊發現血小板上的受體CLEC2是登革病毒激化血小板、釋放胞外囊泡關鍵因子(研究報導:登革熱研究新突破,中研院發現病毒侵略關鍵是血小板),在最近SARS-CoV-2病毒的研究更證實這個機制在病毒引起的發炎反應中扮演重要的調控角色。
研究團隊採取健康受試者的EV和COVID-19病患的EV進行質譜儀(Mass spectrometry)分析,結果指出SARS-CoV-2感染引起的EV表現大量血小板相關蛋白,且具有多種與白血球去顆粒性以及血小板活化凝集的蛋白,顯示COVID-19病人血液中血小板劇烈活化。研究團隊進一步將這兩種不同來源的EVs與嗜中性白血球培養,比對它們誘導NET形成的能力。結果顯示出健康對照組的EV無法誘導NETs形成,但COVID-19 EV誘導了強大的NETs形成,而阻斷CLEC5A和TLR2能夠抑制COVID-19 EV引起的NETs形成。
在動物實驗中,發現感染SARS-CoV-2病毒的小鼠們,感染後3-5天會在肺部有大量的NET產生以及嚴重的細胞浸潤;反觀CLEC5A和TLR2基因剔除的老鼠,發炎以及細胞浸潤的情況大幅降低。
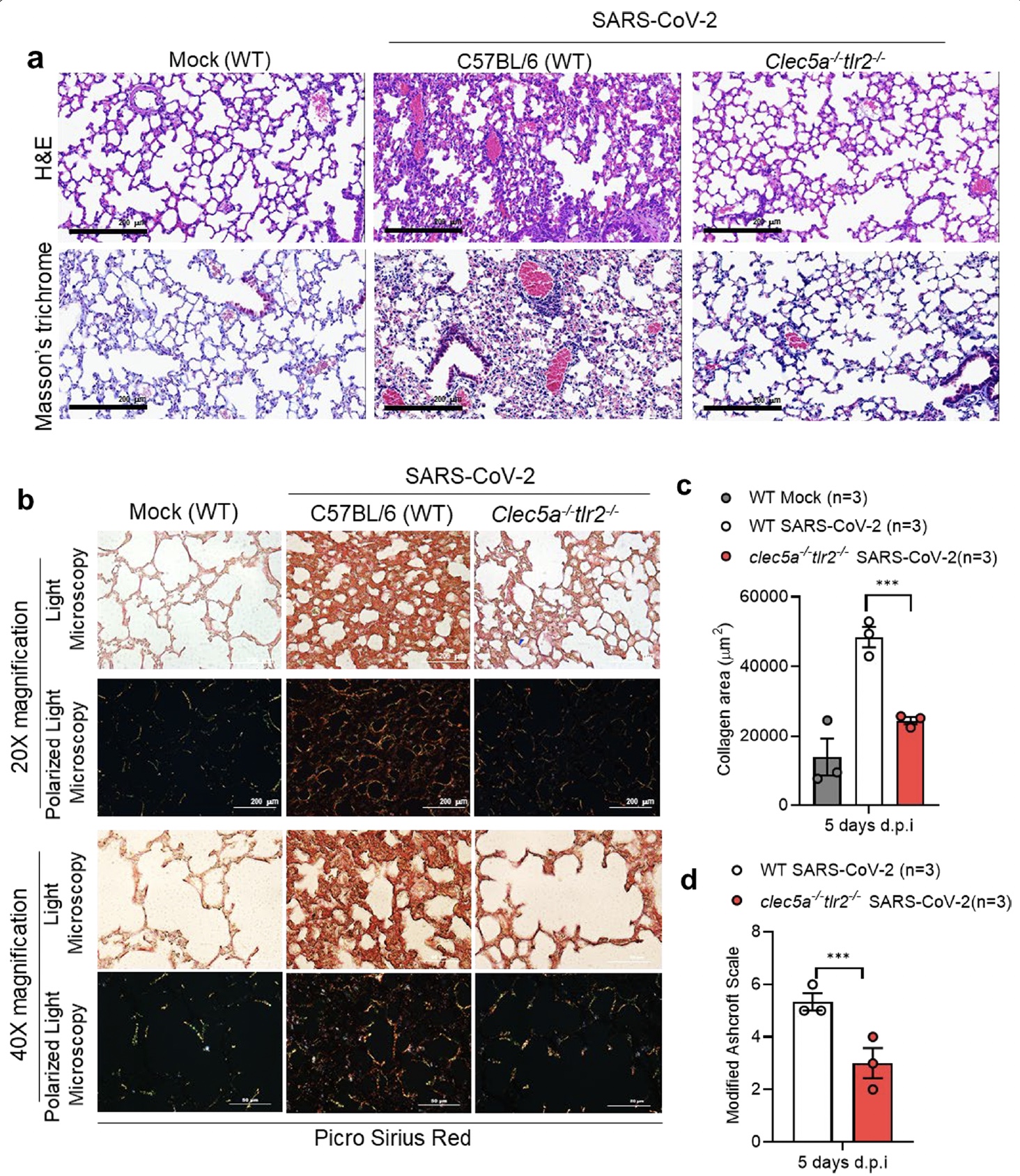 |
| CLEC5A和TLR2基因剔除老鼠和對照組,感染SARS-CoV-2病毒3-5天後,肺部組織切片的肺浸潤狀態對比。 |
這些實驗數據証實,血小板中胞外囊泡(EV)的數值與SARS-CoV-2感染和血栓栓塞密切相關,因此,抑制血小板活化可能成為未來減輕病毒引起的肺部發炎反應的新策略。謝世良老師表示,降低COVID-19急性後遺症(PASC)的發病率,CLEC5A和TLR2是有希望的治療靶點,可在未來減輕血栓炎症,並降低急性後,產生COVID-19後遺症的風險。
近年胞外囊泡已被許多研究指出是細胞間訊息傳遞的重要調節因子,並且被期許具有診斷、治療及作為藥物載體等應用潛力。謝世良研究團隊發現來自病毒活化血小板釋放的胞外囊泡(EVs from virus-activated platelet, aPLT-EVs),是促進發炎反應的內在危險因子(endogenous danger signal),而且經由CLEC5A和TLR2傳遞訊息。阻斷CLEC5A和TLR2不僅成功壓制登革病毒引起的出血性休克,對治療COVID-19血栓併發症也開啟新的方向。研究團隊將會繼續循線探索,找出更多治療疾病的新療法。
論文全文『CLEC5A and TLR2 are critical in SARS-CoV-2 induced NET formation and lung inflammation』。
網址:https://jbiomedsci.biomedcentral.com/articles/10.1186/s12929-022-00832-z














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)