一般來說,乳癌五年存活率達到90%以上,而根據2020年世界卵巢癌聯盟(The World Ovarian Cancer Coalition)公布的數據指出,卵巢癌五年存活率僅有48.6%,在婦癌死亡率中名列前茅。由於卵巢癌初期症狀不明確,發現時往往已經擴散或進展到晚期。此外,卵巢癌的組織型(histotype)眾多,隨著地域人種而有所不同,各個組織型在基因的表現及突變上也亦屬紛雜,這難上加難的困境,使得無論在臨床治療或科學研究上,皆缺乏突破性的發現。
在卵巢癌眾多的組織型中,高惡性度漿液性癌(High Grade Serous Ovarian Carcinoma, HGSOC)所占比例最高,以全球來說,約占70-75%;其次是亮細胞癌(Ovarian Clear Cell Carcinoma, OCCC;10-25%)。亞洲與全球趨勢迥異,HGSOC的比例偏低,約落在30-50%,反而是OCCC逐年上升(在台灣,OCCC占比約19%),並有年輕化的趨勢。
p53是非常重要的抗癌基因,具有抑制細胞增生及維持遺傳物質完整性的功能,半數以上的癌症都有p53的突變,使其失去抑癌功能,而卵巢癌也不例外,特別是HGSOC,p53突變的比例高達95%。有趣的是,OCCC恰巧相反,80%以上的OCCC保留了野生型(Wild type, WT) p53。
在OCCC的p53雖然沒有突變,但癌細胞卻依然增生惡化,而且到癌症晚期,WT p53的卵巢癌比p53突變的其他卵巢癌預後更差。然而,究竟是甚麼原因,讓具有WT p53的卵巢癌細胞能夠規避其抗癌功能,並進一步的生長與惡化呢?答案似乎就在MEX3A這個關鍵的致癌因子上。
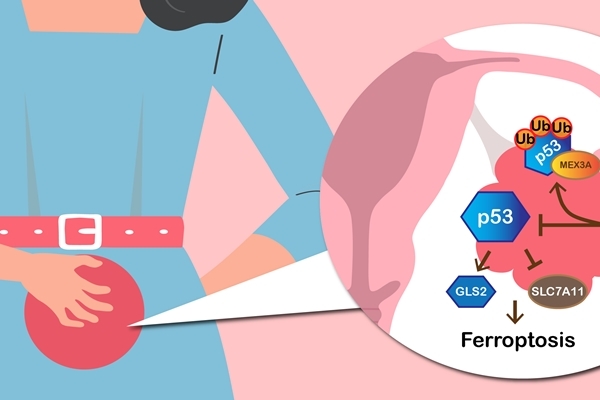
基因體研究中心黃雯華老師研究團隊發現MEX3A對卵巢癌細胞的存活相當重要。在進一步研究中更發現,MEX3A能抑制抗癌基因p53所調控的鐵依賴型細胞死亡途徑(ferroptosis),讓癌細胞當死而不死,進而加速了腫瘤的生成。這項研究成果近期已經發表在「Cancer Research」期刊。
黃雯華老師表示,「我們發現MEX3A控制細胞內活性氧自由基(ROS)的濃度並抑制細胞死亡,在 OCCC 細胞的致癌能力扮演著相當重要的角色。」
MEX3A表現量增加會促進OCCC細胞增生和形成群落的能力(clonogenic ability)。相反地,如果MEX3A的表現量降低,OCCC的細胞生存和增殖能力則會被抑制。在植入人類卵巢癌細胞的小鼠實驗中,有表現MEX3A的癌細胞會快速生長,造成小鼠加速死亡,而抑制MEX3A表現則會抑制腫瘤生長,並增加小鼠存活的時間。研究團隊深入研究後發現,MEX3A之所以能有如此重要的致癌能力,是因為它能促使p53蛋白降解而抑制p53所調控的鐵依賴型細胞死亡(Ferroptosis)。
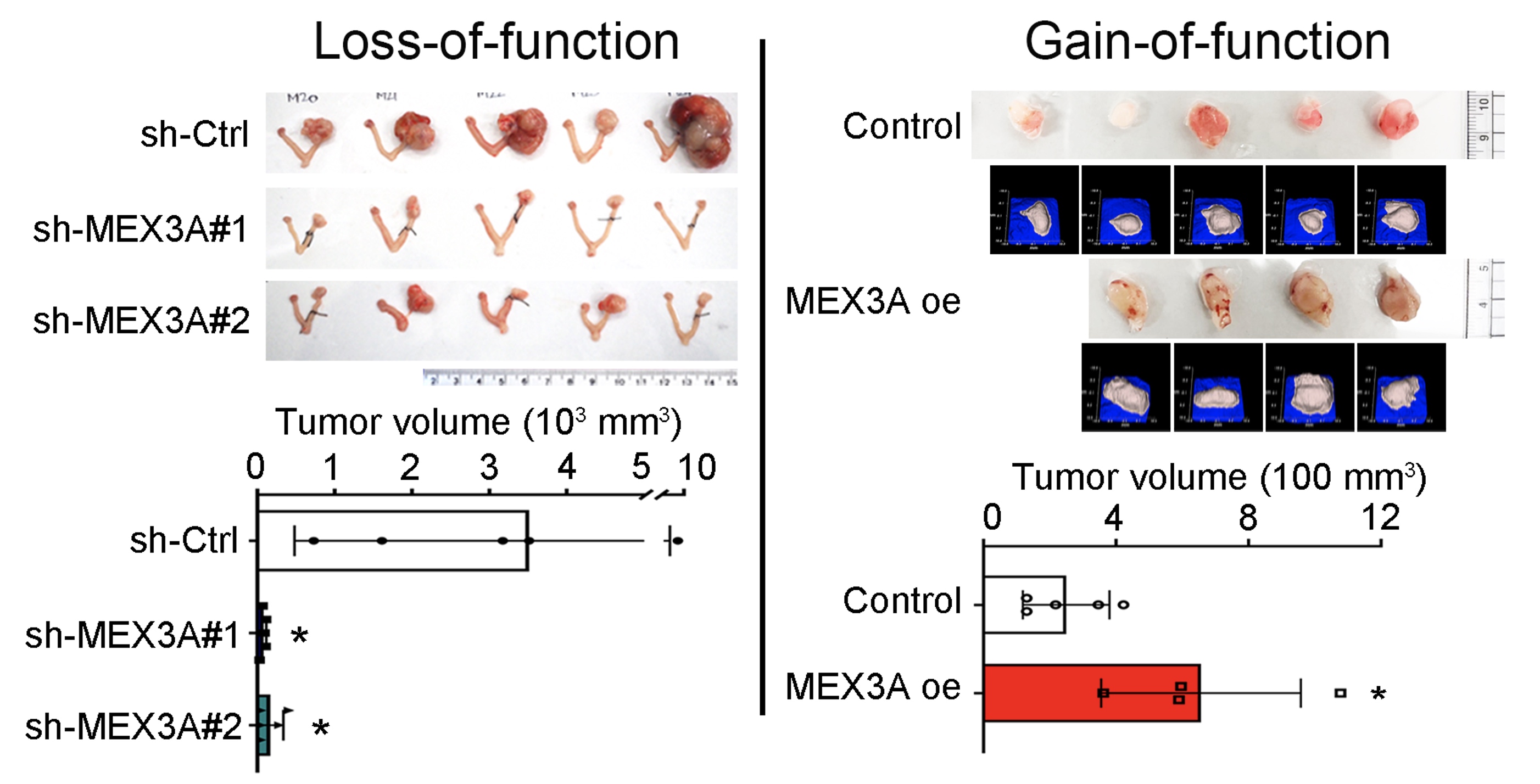 |
| 降低MEX3A表現會抑制卵巢腫瘤生長;相反的,MEX3A表現量增高則會促使腫瘤生長。 |
過去在卵巢癌的研究中,如何讓有WT p53表現的癌細胞能保持p53的低表現量並規避p53的抑癌功能,尚沒有一個很清楚的答案。黃雯華老師團隊的研究成果,提供了一個新穎的調節機制作為解釋:MEX3A藉由泛素化降解p53蛋白質,降解的p53蛋白質失去了原先的功能,原該一手促成的鐵依賴型細胞死亡模式也因而被終止。因此讓癌細胞逃離走向鐵依賴型死亡的命運,最終促成了腫瘤的生長。
這些研究成果讓我們更了解卵巢腫瘤發生的機制,並提供了一個治療WT p53卵巢癌的新穎治療標的-MEX3A。
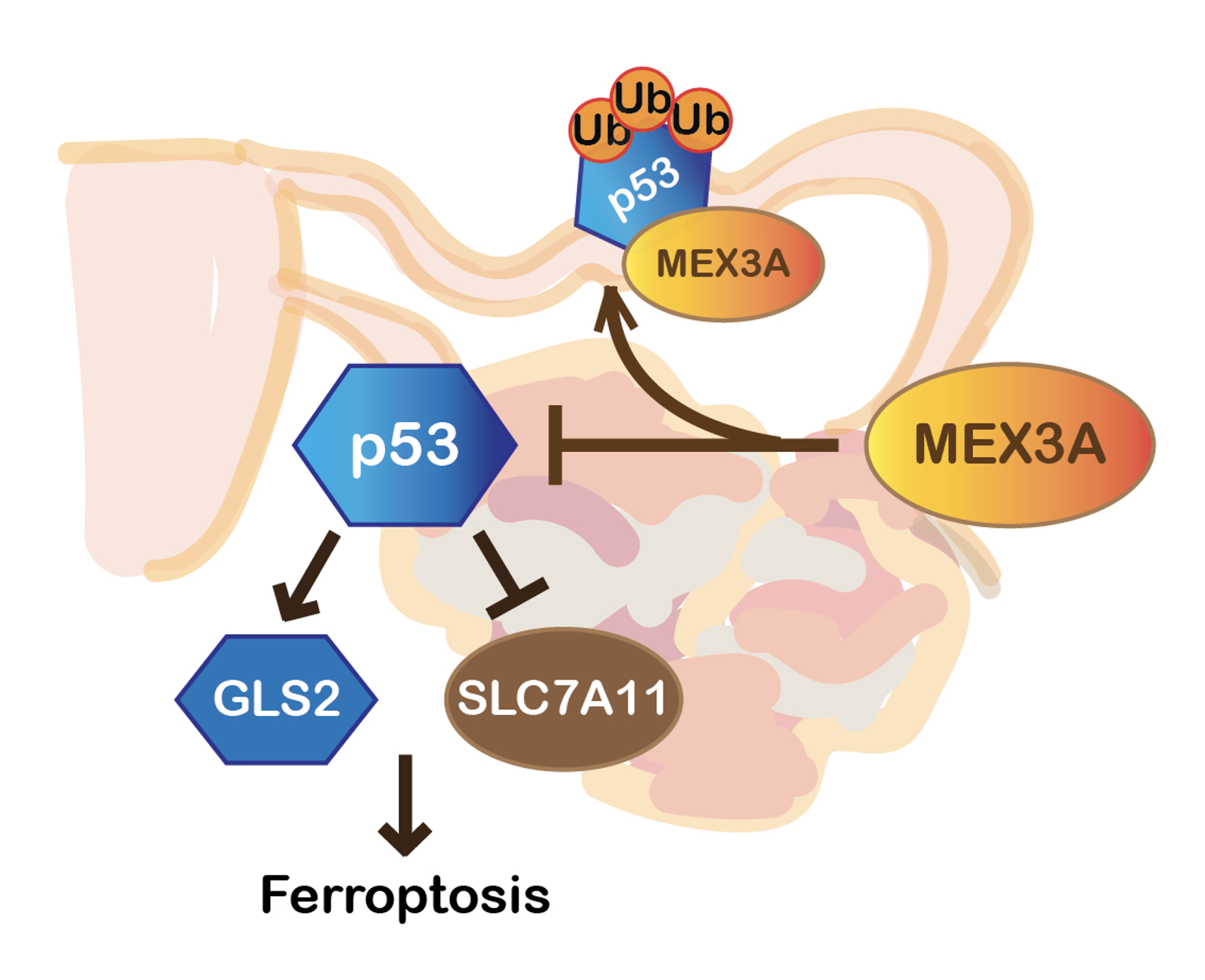 |
| MEX3A藉由泛素化降解p53蛋白質,抑制了p53介導的鐵依賴型細胞死亡,讓癌細胞逃離走向死亡的命運,而促成腫瘤生長。 |
本研究的共同第一作者為王承凱博士、陳子柔研究助理、陳吟詩博士生(中研院國際研究生TIGP-MCB)、張芳珮博士與Samyuktha Sridharan研究助理。其他貢獻者有鄭力慈研究助理、中研院分生所余承欣研究助技師、台北榮民總醫院婦女醫學部張燕後醫師與陳怡仁主任。
論文全文「MEX3A mediates p53 degradation to suppress ferroptosis and facilitate ovarian cancer tumorigenesis」可在線上閱讀:https://doi.org/10.1158/0008-5472.CAN-22-1159












![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)