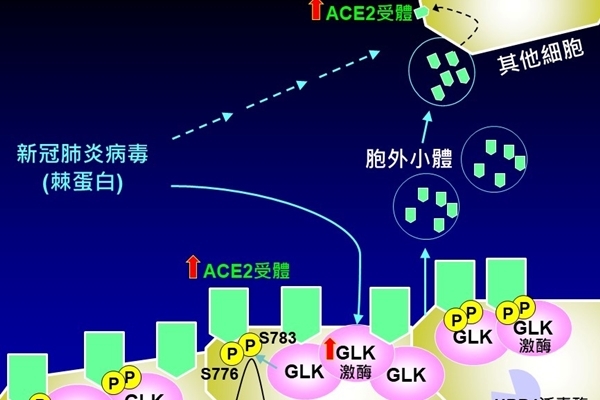
國衛院免疫醫學中心譚澤華特聘研究員與莊懷佳助研究員團隊研究發現,受新冠病毒感染細胞中的蛋白激酶MAP4K3 (又稱GLK)表現量較正常細胞多,且GLK高量表達之上皮細胞比例與疾病嚴重度正相關,並與國衛院感染症與疫苗研究所周彥宏研究員合作,運用活體新冠病毒小鼠實驗證實此感染機制是新冠病毒可大幅感染的關鍵,同時也能解釋新冠疫苗造成副作用的機制。研究成果於今(2022)年7月發表於全球知名醫學期刊《EMBO Molecular Medicine》。
研究團隊分析COVID-19病患檢體之單細胞RNA定序結果,意外發現新冠病毒進入宿主上皮細胞後,棘蛋白會誘發蛋白激酶GLK高量表現。接續運用蛋白質體學、各種生物化學實驗證實,過量表現的GLK會磷酸化ACE2蛋白,使ACE2躲過泛素酶UBR4的泛素化降解機制,造成細胞表面的ACE2蛋白穩定增加。同時,GLK過量表現誘發裝載著ACE2蛋白之胞外小體(exosomes)釋出,傳遞予其他原本ACE2表現量不高的細胞,這些接收了ACE2蛋白的細胞更容易被新冠病毒所感染。研究人員分析COVID-19病患的血清檢體相較正常人之檢體,也發現GLK磷酸化的ACE2蛋白以及裝載著ACE2蛋白之胞外小體大幅增加。這些研究成果證實蛋白激酶GLK過量表現為COVID-19致病機轉之關鍵因子,同時說明新冠病毒快速引發臨床症狀且容易傳播的原因。
研究團隊運用小鼠模式進行動物實驗,當利用GLK之小分子抑制劑(verteporfin)可調降細胞表面ACE2蛋白量,並降低ACE2胞外小體的產生,進而成功抑制小鼠新冠肺炎病毒感染率。而verteporfin與其它可調控GLK及ACE2相關之藥物,皆具潛力成為抑制新冠病毒感染之候選藥物。
此外,研究成果可進一步解釋新冠肺炎引發嚴重發炎反應以及新冠肺炎疫苗產生副作用之機制。新冠肺炎疫苗中主要成分為棘蛋白或棘蛋白RNA,棘蛋白也可能會刺激誘發免疫細胞產生過量GLK,而導致強烈的發炎反應,造成疫苗之副作用。期待透過進一步解開疾病致病機制,進而幫助治療藥物與疫苗的研發與篩選,開發緩解疾病症狀之新穎醫療方式,促進全體人民之福祉。














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)