MSC及外泌體 (Exosome)
MSC 外泌體是由 MSC 分泌的納米級囊泡,是一種非細胞治療劑。MSC 外泌體保留了它們起源的細胞的治療特徵,包括遺傳物質、脂質和蛋白質。外泌體與 MSCs 類似,外泌體可以誘導細胞分化、免疫調節、血管生成和腫瘤抑制。因此,MSC 外泌體已被用於多種實驗模型和臨床研究。
間質乾細胞(MSCs)由於其乾性而具有獨特的生物醫學特性:它們可以模擬自身增殖並可以分化成多系細胞。由於主要組織相容性複合體 (MHC) I 類分子的低表達和少數 MHC II 類分子的表達,MSCs 具有低免疫原性。重要的是,MSCs 已被證明在各種疾病模型中具有免疫調節和再生功能。鑑於這些特性,MSCs 已在數十年的臨床試驗中進行了評估 。儘管使用 MSCs 的一些臨床前研究和臨床試驗的結果看似很有希望,但在其他研究中,MSC 治療後臨床結果通常沒有顯著改善疾病嚴重程度,這使得基於 MSC 的治療存在爭議 。
MSCs 影響的這些差異可能是由於注入的 MSCs 植入不良,供體依賴性變異,或由於細胞在微脈管系統中的駐留而可能導致的輸注毒性 。此外,MSCs 在體外擴增過程中的衰老會降低細胞的生產能力,並且會通過引起炎症來增加疾病的嚴重程度。為了保證一致和穩定的治療效果,需要改進 MSC 治療策略,策略應考慮當前的障礙,例如體內存活率低、發炎病變的遞送不准確以及供體間的差異。研究人員試圖通過改善 MSCs 向病灶的遷移並用生物活性分子如 IFN-γ 和 TNF-α對它們進行預處理來增強 MSCs 的治療效果]。此外,包括支架和水凝膠在內的共同給藥策略的使用使疾病治療更加謹慎和準確。改善基於 MSC 的治療的另一種方法是使用細胞外囊泡 (EV) 或外泌體 。
從原核生物到真核生物,在細胞之間藉由釋放的EV來傳遞生物信號參與細胞間通訊。根據它們的生物起源,EV 分為三大類:外泌體( exosomes)、微泡(microvesicles)和凋亡小體(apoptotic bodies) 。外泌體的最小尺寸範圍約為 50 至 150 nm,當多泡體(multivesicular)與細胞膜融合時,外泌體被釋放到細胞外環境中。這些納米大小的囊泡含有許多細胞成分,包括細胞因子和生長因子、信號脂質以及 mRNA 和調節性 miRNA,外泌體的成分根據其細胞來源而有所不同。值得注意的是,MSC 外泌體可能比 MSC 更適合臨床應用。MSC 外泌體可能沒有免疫原性問題,並且不太可能像注入的 MSC 一樣被困在肺或肝臟中,同時仍保持其來源細胞的治療功能。鑑於 MSC 衍生的外泌體在臨床前研究中的治療潛力已得到證實。
MSC 外泌體的治療特性
間充質乾細胞已被評估為多種罕見疾病的替代療法,因為它們具有免疫調節活化免疫細胞和刺激組織再生的能力。兩種主要的細胞行為是其治療效果的基礎:直接細胞介導的作用和可溶性因子釋放引起的環境變化 。MSC分泌蛋白組是指釋放到培養基中的可溶性因子,在釋放的物質中,微泡(MV,直徑 0.1-1 mm)和外泌體(直徑 50-150 nm)作為 MSCs 和靶細胞(包括 MSCs)之間的細胞間介質發揮作用 。納米級外泌體(Nanosized exosomes)特別被認為是 MSC 替代品,因為它們具有與 MSC 相似的治療特徵。外泌體可能比 MSCs 具有更大的臨床應用潛力,因為它們具有較低的免疫原性和致瘤性 。因此,MSC外泌體的使用為MSCs的臨床應用開闢了新的途徑。
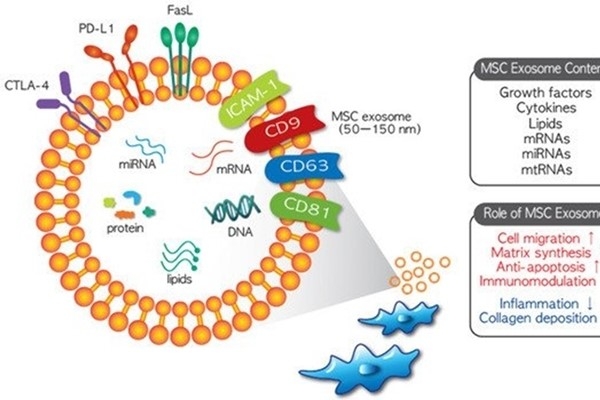
MSC(間充質乾細胞)外泌體的組成和治療功能。來自 MSCs 的外泌體可能含有生長因子、細胞因子、DNA、脂質、mRNAs、miRNAs 和 mtRNAs。與其起源的細胞相似,MSC 外泌體具有治療特性,包括刺激細胞遷移和細胞外基質合成、抗凋亡作用、免疫調節和抗炎作用以及刺激膠原蛋白沉積。由於這些獨特的治療特徵,MSC 外泌體治療的可行性目前正在幾項臨床研究中進行評估。
MSC 衍生的外泌體最重要的特性是它們的“(載貨cargo)”功能,它們包含多種經過驗證的治療劑,MSC外泌體的內容包括核酸、蛋白質和脂質,描述了超過850個基因產物和150個miRNA 。此外,它們的組成可能會因 MSCs 的分離來源和外部刺激而有所不同,這也是不同來源的 MSCs 表現出不同特徵或治療效果的原因之一 。儘管來自不同 MSC 來源的外泌體的特徵可能有所不同,但它們通常具有治療作用。MSC 外泌體將其內容物(如 mRNA、miRNA 和蛋白質)水平轉移到靶細胞中,以改變這些細胞的細胞功能 。儘管 MSC 外泌體內吞作用的機制尚未完全闡明,但包括囊泡-細胞融合、吞噬作用、微胞飲作用和/或受體介導的內吞作用在內的幾個細胞過程被認為與內化(internalization)有關 。
在臨床前研究中已經描述了 MSC 外泌體的幾個臨床特徵。例如,MSC 外泌體通過調節內源細胞的增殖和凋亡來加速組織再生過程。MSC 外泌體也影響一些免疫細胞的命運決定,從而促進過度炎症的減弱或恢復免疫穩態 。此外,MSC 外泌體通過刺激各種細胞信號通路誘導血管生成 。鑑於這些有希望的結果,MSC 外泌體應用的安全性和有效性目前正在針對各種疾病的臨床試驗中進行評估。以下,我們根據疾病類型回顧 MSC 外泌體的治療潛力。
免疫相關疾病
MSCs 和 MSC 衍生的外泌體最重要的臨床特徵是它們的免疫調節功能 。免疫相關疾病通常是由於免疫系統的失衡以及隨後身體對特定類型免疫反應的偏向激活的反應。MSC 外泌體作為 MSC 介導的各種免疫細胞免疫調節的主要介質引起了人們的興趣。來自 MSCs 的外泌體在調節各種免疫細胞亞群和隨後促進免疫穩態中發揮作用,就像它們的起源細胞一樣。MSC 外泌體已被證明對活化的免疫細胞具有抑制功能,包括效應 T 細胞、小膠質細胞 、巨噬細胞和 NK 細胞。相比之下,MSC 外泌體有助於向調節型免疫細胞(如耐受性樹突細胞、M2 巨噬細胞和調節性 T 細胞確定譜系,從而促進免疫系統穩態。臨床前研究證明的調節功能激發了針對各種自身免疫性疾病的臨床試驗。
MSC 外泌體有效抑制 Th1 細胞的過度增殖和活化。例如,在動物移植物抗宿主病 (GvHD) 模型中,表達 CD39 的 CD4 + Th1。此外,針對 GvHD 的治療功能已在人體研究中得到證實 。根據先前使用接觸超敏反應 (CHS) 模型小鼠的研究,輸注來自臍帶衍生的 MSC (UC-MSC) 的外泌體導致 Th1 細胞水平降低,隨後分泌 IFN-γ,同時 Treg 誘導增加。EV 的內化也被證明與信號轉導和轉錄激活因子 1 (STAT1) 的表達降低有關,STAT1 在 Th1 細胞發育中起著至關重要的作用 。
MSC 外泌體還可以抑製過度的過敏性炎症,據報導,輸注源自脂肪組織來源的 MSC (AT-MSC) 的外泌體通過改善病理症狀和肥大細胞浸潤到皮膚病變中來緩解特應性皮炎 (AD) ,由於抑制第 2 組先天淋巴細胞 (ILC2) 通路或促進 Treg 群 。鑑於這些臨床前發現,MSC 外泌體的臨床潛力目前正在四種不同的免疫疾病中進行評估。
大約 35-50% 的患者在異基因造血幹細胞 (HSC) 移植後患有 GvHD,這是由捐贈的造血幹細胞將受體身體系統視為外來並攻擊它們引起的。慢性 GvHD (cGvHD) 的特徵是皮疹、腹部腫脹、眼睛乾澀、視力改變、氣短、肌肉無力和關節緊繃 。在這些症狀中,乾眼症是最常見的,發生在 40-76% 的患者中,其嚴重程度可以反映疾病的預後。乾燥性角結膜炎是由淚腺周圍的淋巴細胞浸潤引起的,導致組織退化和功能障礙。由於皮質類固醇或環孢菌素 A 等免疫抑製劑非特異性抑制免疫系統,並不適用於所有患者,因此 MSC 已被視為治療 cGvHD 乾眼症的替代療法 。
2019年12月註冊了一項評估臍帶間充質乾細胞(UMSC)外泌體緩解乾眼症狀療效的臨床試驗(NCT04213248)。值得注意的是,該試驗的目的是分析疾病指標的反應,例如眼淚量和對組織的損傷程度,以滴眼劑形式應用外泌體而不是血管內註射的外泌體治療。
第一型糖尿病 (T1DM) 是另一種眾所周知的自身免疫性疾病,需要終生管理,症狀包括體重減輕、疲憊、皮膚發癢和視力模糊。體內的免疫細胞以未知原因攻擊胰腺β細胞,對胰島素產生和隨後的葡萄糖代謝產生不利影響。由於目前還沒有特定的治療方法,T1DM 患者需要每天注射胰島素或安裝胰島素泵以維持血糖水平的正常範圍 。為了解決缺乏治療 T1DM 特異性藥物的問題,據報導Nojehdehi 等人利用來自 AD-MSCs 的外泌體通過增加脾臟中的 Treg 數量和再生胰島,在鏈脲佐菌素誘導的 T1DM 小鼠模型中具有治療作用 。來自月經 MSCs 的外泌體在大鼠模型中顯示出相似的治療潛力。目前正在進行一項臨床試驗,評估重複靜脈輸注 UCB 血液來源的 MSC 外泌體對 T1DM 的影響(NCT02138331)。
除了這些自身免疫性疾病,MSC 外泌體已被證明可以緩解實驗性牙周炎。牙周腔內的菌群失調會促進牙齦卟啉單胞菌和具核梭桿菌等病原微生物群的生長,從而在這些自身抗體侵入循環系統和各種器官後促進自身抗體的產生和宿主免疫反應的破壞。據報導脂肪組織來源的 MSC (AD-MSC) 外泌體在牙周韌帶和組織再生中發揮支持作用 。在一項臨床研究中,正在評估自體施用 AD-MSC 外泌體在緩解 18 至 50 歲患者牙齦炎症和組織損傷方面的療效(NCT04270006)。
最後,多器官功能障礙綜合徵 (MODS),心血管手術後導致死亡的術後並發症,正在用從 UC-MSCs (NCT04356300) 中分離出來的外泌體進行治療。促炎細胞因子 IL-6 通常被用作 MODS 的預後指標,因為 IL-6 是響應組織損傷和炎症刺激而釋放的 。評估 MSC 外泌體的安全性和有效性、短期和長期免疫反應、IL-6 濃度(早期 3 天)和過敏反應,包括皮疹、瘙癢和過敏性休克(長達 6 個月)以及器官衰竭評估分數正在調查中。
傷口癒合
來自各種 MSCs 的外泌體已被證明可以加速傷口修復。儘管傷口癒合是一種複雜的生理現象,但 MSC 外泌體通過促進皮膚細胞成分的增殖、分化、定位 和誘導免疫細胞的分化來促進恢復過程。皮下施用源自 iPSC-MSCs 的外泌體已被證明可通過促進成纖維細胞分泌 I 型和 III 型膠原蛋白和彈性蛋白來加速動物模型中的傷口修復 。此外,移植的 MSC 外泌體不僅在血管生成中發揮關鍵作用,而且在傷口部位血管的成熟以促進癒合過程。
大皰性表皮鬆解症 (EB)是一種以皮膚脆弱和對機械性創傷起水泡為特徵的疾病,有 30 種不同的亞型。在疾病亞型中,由 VII 型膠原 (COL7A1) 基因突變和隨後缺乏蛋白質產生引起的隱性營養不良性大皰性表皮鬆解症 ( RDEB ) 可以通過骨髓來源的 MSC (BM-MSC) EV 得到緩解,因為它們捐贈了自己的類型VII 膠原蛋白並誘導宿主成纖維細胞產生這種蛋白質。鑑於這些有希望的結果,啟動了 I/IIA 期臨床研究,以測試異基因 MSC 外泌體在 EB 中局部應用的安全性和可行性。將在 10 名參與者 (NCT04173650) 中評估劑量限制性毒性和傷口大小衰退。此外,另一項使用 BM-MSCs 的前瞻性臨床研究報告稱,靜脈輸注耐受性良好,長達 12 個月沒有嚴重並發症,並且 EB 症狀在 2 個月內短暫緩解 (NCT02323789)。
除了皮膚和表皮傷口,MSC 外泌體也已應用於其他器官的傷口癒合。特發性黃斑裂孔 (MH) 可導致高度近視眼視網膜脫離 。儘管大多數患者使用通過玻璃體切除術 (PPV) 進行的手術治療來治療這種情況,但那些患有特別大且持續時間長的 MH 的患者在標準 PPV 手術後預後較差。 因此,已經探索了促進 MH 功能和身體恢復的替代或輔助工具。 據報導,七名患者中的六名(兩名接受MSC外泌體治療的患者和五名在手術後通過玻璃體內註射使用臍帶衍生的MSC外泌體治療的患者)顯示出完全的黃斑閉合,而通過最佳矯正視力評估的五名患者顯示出改善的視覺功能。 BCVA) ,臨床研究的主要結果測量 (NCT03437759)。
神經系統疾病
在承認移植細胞難以遷移到現有神經網絡並且其治療效果是由異質 EV 的分泌協調後,幹細胞治療的重點已從直接的細胞間相互作用轉移到旁分泌相互作用 。此外,修飾分子以使它們能夠穿過血腦屏障(BBB)的進展使外泌體成為神經疾病和精神障礙的治療候選者。Alvarex-Erviti 等人開發了載有GAPDH siRNA的神經元靶向外泌體,靜脈注射這些外泌體會導致神經元細胞中的特定基因敲除 。鑑於有證據表明外泌體可以穿過 BBB,Xin 等人通過靜脈內途徑將含有 miR-17-92 的大鼠骨髓來源的 MSC 外泌體施用於中風模型,並顯示出增強少突神經發生、神經發生和神經可塑性以及功能恢復。最近,靜脈內給藥的 MSC 外泌體已被修改以靶向大腦的特定區域。
另一個通往大腦的直接通路是鼻腔,該途徑可用於繞過 BBB 將治療劑輸送到大腦 在毛果芸香鹼(Pilocarpine)誘導的癲癇持續狀態小鼠模型中,MSC 衍生的外泌體經鼻內給藥,據報導在 6 小時內到達海馬體,在那裡它們具有神經保護和抗炎作用。佩雷茨等人,評估了 MSC-外泌體鼻內給藥對 BTBR T+tf/J (BTBR) 小鼠(一種公認的自閉症樣行為模型)的影響,並報告了男性與男性的社會互動增加,重複行為減少和母體行為改善,表明減輕自閉症譜系障礙相關症狀的治療策略。鑑於靜脈內遞送的外泌體可以穿過 BBB,洛杉磯神經病學協會的 Jordan 小組啟動了兩項針對顱面神經痛 (NCT04202783) 和神經退行性疾病驅動的抑鬱、焦慮和癡呆 (NCT04202770) 的獨立試驗。
心血管疾病
儘管死亡率在過去 20 年中急劇下降,但心血管和循環系統疾病仍被認為是全球主要的死亡原因 。雖然美國的主要死因是心血管疾病,但在中國,缺血性心髒病是心血管疾病的主要原因,導致死亡率居高不下 。由於缺血性心髒病中的心肌細胞丟失,研究人員將注意力集中在再生醫學對預防心血管疾病的重要性上。MSCs 分化成多種細胞類型的能力導致研究 MSCs 作為心臟組織再生和修復的主要細胞治療劑。
儘管 MSC 幹細胞治療的結果很有希望,但仍不清楚它們是如何工作的。弗雷曼等人在急性心肌梗塞後的豬心臟梗塞區,僅觀察到來自靜脈注射的 50 × 10 6 個移植細胞的 30,000 個細胞,佔0.06% 。蒂默斯等人表明在豬心肌梗塞後 MSC 條件培養基(conditioned medium)處置保留了心臟功能,這表明 MSC 分泌物可能具有血管生成潛力
鑑於分泌性外泌體的功能取決於它們所含的物質,例如細胞因子、蛋白質、mRNA、miRNA 和 rRNA,因此已經進行了研究以確定其參與心臟再生的關鍵因素。安德森等人,鑑定了 MSC 衍生的外泌體中的 1927 種蛋白質並分析了核因子-kappaB;信號傳導作為 MSC 誘導的血管生成的關鍵介質 。在大鼠心肌梗死模型中,發現 MSC 外泌體的心臟保護作用是由 miR-21 介導的,通過 PTEN/Akt 通路增強細胞存活。最近的一項研究報導,含有 miR-25-3p 的 MSC 外泌體通過降低 EZH2、H2K27me3 和 SOCS3 的表達而具有心臟保護作用,通過靶向促凋亡蛋白和炎症基因來減輕心肌梗塞 。根據 MSC 衍生的外泌體促進中風後血管生成重塑和功能恢復的發現,伊斯法罕醫科大學最近的一項臨床研究正在探索使用裝載 miR-124 的 MSC 衍生的外泌體來改善急性中風患者的血管生成(NCT03384433)
癌症
MSC 衍生的外泌體在癌症治療中的應用已經研究了幾年。儘管關於腫瘤進展的功能存在一些爭議,但一些報導顯示MSC EVs在腫瘤轉移中的抑製作用。2014 年,小野等人發現BM-MSC 外泌體可以抑制轉移性癌細胞增殖,從而通過 miR23b 介導的 MARCKS 抑制促進轉移性乳腺癌細胞的休眠 。MSC 外泌體還可以通過鈣/鈣調蛋白依賴性蛋白激酶 (CaM-K) 和 Raf/MEK/ERK 激酶級聯信號介導胃癌細胞耐藥性發展的變化,這將提高化療的效率 。
然而,也有研究發現MSC外泌體會加速癌細胞的遷移和癌症相關通路的表達,包括Wnt信號通路。同樣,MSC 外泌體被證明可誘導胃癌細胞中的上皮間質轉化 (EMT),並通過上調癌症生長和遷移來增強致瘤性 。在促進癌症生長的背景下,它們的血管生成特性也值得關注。因此,MSC 外泌體癌症治療有時被稱為“雙刃劍”。為了克服這一點,研究人員專注於 MSC 外泌體的貨物功能。例如,用紫杉醇(紫杉醇;PTX)處理的 MSCs 衍生的外泌體顯示出改善的腫瘤抑製作用,與紫杉醇單一處理相比,直接抑制腫瘤細胞生長,濃度可降低 1000 倍 。此外,靶向腫瘤相關基因如 polo 樣激酶 1 (PLK-1) 的 siRNA 可以加載到 MSC 衍生的外泌體中用於膀胱內治療。
因此,含有靶向致癌 Kras G12D突變的 siRNA 的 MSC 外泌體正在臨床試驗中用於治療胰腺癌 (NCT03608631)。Kras G12D突變是胰腺癌中常見的突變,是一種很有前景的治療靶點。Kalluri 小組已開發出表達 CD47 和 si- 或 sh-RNA 用於 Kras G12D的工程外泌體 (iExosomes) 。他們證明 iExosomes 抑制致癌 Kras 並提高胰腺癌小鼠模型的存活率。基於這些發現,需要在臨床試驗中評估 iExosomes 在 Kras G12D相關胰腺癌患者中的安全性和可行性。
MSC 外泌體作為 COVID-19 支持性治療
最近,由新型冠狀病毒嚴重急性呼吸系統綜合症冠狀病毒 2 (SARS-CoV-2) 快速廣泛感染引起的 2019 冠狀病毒病 (COVID-19) 已成為對全球公共衛生和世界經濟的最大普遍威脅. 因此,非常需要預防和治療感染的實用方法。
與嚴重急性呼吸綜合徵 (SARS-CoV) 和中東呼吸綜合徵 (MERS-CoV) 等其他冠狀病毒類似,SARS-CoV-2 主要針對人類呼吸系統,症狀包括發燒、乾咳、咳痰、疲勞、頭痛, 和呼吸困難。重要的是,與其他冠狀病毒不同,這種病毒會影響下呼吸道,導致肺上葉浸潤和隨後的低氧血症。此外,感染 SARS-CoV-2 的患者偶爾會出現腹瀉作為症狀之一 。SARS-CoV-2 使用其 S 蛋白與宿主肺細胞上存在的血管緊張素轉換酶 2 (ACE2) 受體結合,一旦內化,就會開始自我複制。雖然 CD4 +和 CD8 +分別表達 HLA-DR 和 CD38 的 T 細胞保持激活狀態,據報導,COVID-19 患者外周血中這些細胞的數量減少了 。SARS-CoV-2 感染會破壞患者免疫系統的功能。失調的免疫效應細胞分泌大量促炎細胞因子(例如,IFN-α、IFN-γ、IL-1β、IL-6、IL-12、IL-18、IL-33、TNF-α、TGFβ)和趨化因子(例如,CCL2、CCL3、CCL5、CXCL8、CXCL9、CXCL10),導致所謂的“細胞因子風暴”。細胞因子分泌增加和隨後被激活的免疫細胞(如炎性單核細胞和中性粒細胞)浸潤肺組織會引發急性呼吸窘迫綜合徵 (ARDS),這被廣泛認為是導致 COVID-19 死亡的最關鍵因素之一 , 因此,迫切需要一種有效的治療方法來預防 COVID-19 誘導的細胞因子風暴。
如上所述,MSCs 或源自 MSCs 的外泌體最突出的特徵是它們的免疫調節能力。MSC 外泌體或 EV 已被用於治療氣道疾病,例如哮喘 、支氣管肺發育不良和ARDS 。MSCs 及其衍生物也被證明可以通過減輕症狀和恢復正常生理功能來有效抑制流感病毒感染。此外,臨床試驗表明,MSC 移植可降低流感病毒引起的肺損傷的嚴重程度並降低死亡率,這表明 MSC 和 MSC EV 在 COVID-19 治療中具有潛在作用。儘管與 MSCs 本身相比,外泌體的生產在技術和經濟上效率低下,但外泌體在治療氣道傳播疾病方面具有優勢,因為與通過靜脈途徑注射的 MSCs 不同,外泌體不會被困在肺部。此外,尺寸約為 100 nm 的外泌體可以通過氣溶膠吸入應用,同時保留其免疫調節功能。由於其獨特的磷脂膜結構,生物活性分子,包括有前途的藥物,可以插入外泌體,通過融合靶細胞膜並將貨物轉移到細胞質中,可以最大限度地發揮其作用。
目前,有四項臨床試驗探索使用 MSC 外泌體作為 COVID-19 感染患者的支持性治療。首例題為“吸入間充質乾細胞外泌體治療重症新型冠狀病毒肺炎的初步臨床研究”旨在探索氣溶膠吸入異基因AT-MSCs衍生的外泌體在重症患者中的治療潛力(NCT04276987)。這種 MSC 外泌體治療的安全性正在另一項臨床研究 (NCT04313647) 中進行評估。由俄羅斯臨床醫生領導的另一項研究正在測試吸入 MSC 衍生的外泌體是否可以抑制免疫系統對病毒的過度反應並刺激再生過程(NCT04491240、NCT04602442)。除了這三項研究之外,使用來自非 MSC 來源的 EV 或外泌體的研究包括供體來源的 COVID-19 特異性 T 細胞 (NCT04389385) 或具有 300 多種來自人類的生長因子、細胞因子和趨化因子的羊膜幹細胞和上皮細胞羊水 (HAF) (NCT04384445) 也在進行中。即使這些正在進行的研究報告了成功的結果,仍然有幾個問題需要解決。值得注意的是,在實際臨床應用之前應解決安全問題,因為據報導 MSC EV 與其來源的細胞一樣具有促凝活性。一項隊列研究表明,重症 COVID-19 患者的症狀之一是高凝狀態; 因此,必須按照血漿交換療法的建議在輸注前去除外泌體貨物中的促凝血因子和過多的促炎細胞因子。此外,為了加快和鞏固臨床前進程,需要完善的疾病模型(例如非人類靈長類動物模型)來評估新療法和潛在疫苗的安全性和有效性。
未來展望
本文根據疾病類型全面回顧了MSC外泌體的治療特點和臨床試驗現狀。儘管臨床前研究報告了許多有希望的結果,但需要對 MSC 外泌體治療進行一些改進才能獲得更好的結果。首先,應在外泌體分離之前評估 MSCs 對特定疾病的適用性。間質乾細胞的基因修飾可以改善來自這些間質乾細胞的外泌體的治療功能。基因改造的主要目標之一可能是 miRNA。miR-143 的過表達提高了 MSC 外泌體對癌細胞遷移和侵襲的抑制功能。除了上面討論的 miRNA 之外,還有許多其他 miRNA 是外泌體遺傳操作的潛在目標。CXCR4 和 GATA-4等具有特定治療作用的蛋白質的過度表達也已被證明可以改善 MSC 外泌體的功能。因此,在對 MSCs 進行基因操作之前,重要的是要確定可以在外泌體中操作以治療特定疾病的精確基因靶點。
圖 2. MSC 外泌體治療的當前臨床試驗。按疾病類型分類的 16 項已註冊臨床試驗的匯總圖。括號中的數字表示正在進行的臨床研究(~2021 年 1 月)。
其次,通過將靶分子直接遞送到MSC外泌體中來增強MSC外泌體的治療效果。已經開發了多種插入方法,包括被動加載、超聲處理、電穿孔、擠壓和光誘導加載 。正如我們上面所討論的,抗癌藥物已被加載到外泌體中以獲得更好的臨床結果。經研究報導,薑黃素是一種有效的免疫抑製劑,通過將其包裹在外泌體中來提高其抗炎活性。另一種抗炎藥,即 STAT3 抑製劑 JSI124,當通過鼻內途徑以外泌體的形式引入時,可有效抑制神經炎症。除了外泌體介導的藥物遞送,長內源性 RNA 或小干擾性 RNA 的加載和遞送已被證明可以抑制癌症並導致白血病細胞凋亡。
支持材料可用於最大限度地發揮 MSC 外泌體的治療功能。在生物相容性助劑中,各種水凝膠最近引起了人們的關注。在缺血性實驗模型中,含有殼聚醣水凝膠的胎盤衍生的 MSC 外泌體顯示出增強的治療效果,具有體內保留和外泌體內容物(包括蛋白質和 miRNA)的穩定性 。其他水凝膠已被證明可以通過補充物理缺陷來加強傷口修復過程。在類似的情況下,用 MSC 外泌體和支架包裝組織比在骨或子宮內膜再生模型中的初始治療產生更好的結果。此外,用脂多醣等細菌物質預處理 MSCs 可用於開發適用於解決慢性炎症的疾病或類型特異性外泌體。最後,可以與肝細胞受體結合的支鏈澱粉的表面修飾被證明可以通過改善其對受損器官的靶向性來增強 MSC 外泌體的治療效果。
為了使基於外泌體的療法在臨床應用中安全且成功,必須探索所施用的外泌體的生物分佈。目前,有各種研究來評估從不同來源獲得併在不同疾病模型中治療的外泌體的生物分佈。在患有急性腎損傷的小鼠中,5 小時後從損傷部位檢測到靜脈內遞送的 MSC 外泌體,24 小時後檢測不到 。在荷瘤小鼠中,腹腔注射後 24 小時和 48 小時,外泌體在腫瘤區域的積累顯著增加。一般來說,已知靜脈內遞送的外泌體主要在肝臟和脾臟中積累,但是,根據細胞來源和給藥途徑,生物分佈模式可能不同 。在使用外泌體設計治療策略時,必須先仔細考慮 MSC 來源、給藥途徑和生物分佈。
總之,成功的 MSC 外泌體治療各種罕見疾病需要疾病和/或患者定制治療。為此,需要詳細識別每種目標疾病的特徵和發病機制,選擇可行的外泌體貨物,確定調節所選因素的方法,以及改進對病變的遞送。
參考資料: Therapeutic Features and Updated Clinical Trials of Mesenchymal Stem Cell (MSC)-Derived Exosomes














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)