2020.03.17 l 第20屆國際自由基研究學會雙年年會 (活動因疫情取消)
一月 02, 2020Welcome to the 20th Biennial Meeting for the Society for Free Radical Research International (SFRR 2020) to be held on March 17-20, at Chang Gung University of Science and Technology (CGUST) and Chang Gung University (CGU), Taoyuan, Taiwan. We have an exciting scientific and cultural program, and hope to promote novel perspectives in free radical biology and medicine. Please mark your calendars and plan to join us in Spring 2020!
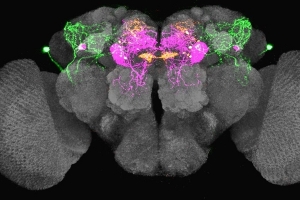
是誰操控你飢渴的慾望?中研院破解腦內迴路之謎
十二月 31, 2019是誰操控你飢渴的慾望?中央研究院分子生物研究所林書葦助研究員與本院國際研究生學程博士生芭雅希(Bhagyashree Senapati)組成的跨國團隊,解密果蠅腦中的神經迴路,首次發現一種名為leucokinin的神經傳導物質,透過調控不同的腦神經元,影響果蠅進行覓水或覓食行為,解開了渴、餓訊號在腦中相互作用的神經機轉,有助於了解更複雜的人腦。此研究成果已於今(108)年12月發表在《自然: 神經科學》(Nature Neuroscience)。
艾默生物醫學
十二月 31, 2019| 申請案號 | 108DOMA021 |
| 計畫狀態 | 執行中 (On Going) |
| 細胞治療項目 | 自體脂肪幹細胞移植 |
| 適應症 | 退化性關節炎及膝關節軟骨缺損 |
| 適應症詳述 | 膝關節退化性關節炎 |
| 醫療機構規模 | 醫學中心 Medical Center |
| 醫療機構所在行政區 | 新北市 |
| 連絡資訊 | https://www.femh.org.tw/ 特約門診專線:02-77281099 幹細胞治療專任護理師諮詢專線:0925-191-016 |
| 全部操作醫師 | 張至宏、王正次 |
| 費用說明 | (費用尚待地方衛生局核定) 單劑型供病人單腳單次注射,預估費用34萬2,100元,採分段付費方式。 雙劑型供病人雙腳單次注射,預估費用41萬6,100元,採分段付費方式。 |
| 費用收取方式 | (費用尚待地方衛生局核定) 1. 單劑型:收費方式為分階段付費,共分九次收費。V0收篩檢費用約15,000元,V1收取脂肪費用約233,840元,V2收術後回診費約690元,V3收取細胞注射費用約48,790元,V4收取追蹤費約540元,V5收取追蹤費約28,540元,V6收取追蹤費約540元,V7收取追蹤費約1080元,V8收取追蹤費約13,080元。 2. 雙劑型:收費方式為分階段付費,共分九次收費。V0收篩檢費用約15,000元,V1收取脂肪費用約291,840元,V2收術後回診費約690元,V3收取細胞注射費用約57,790元,V4收取追蹤費約540元,V5收取追蹤費約35,540元,V6收取追蹤費約540元,V7收取追蹤費約1080元,V8收取追蹤費約13,080元。 3. 特殊狀況退費: a. V1狀況-1:若病人於採集脂肪組織時發生檢體量不足之情形,因無充足檢體需要進行產品製備,病人可當場放棄細胞治療程,僅收約18,000元手術相關費用。 b. V1狀況-2:若病人的檢體量充足,但於採集後發生產品無法達放行標準,因檢體已採集且細胞製備流程已啟動,單劑型療程醫院將退回172,800元,雙劑型療程醫院將退回219,200元。 c. V1狀況-3:病人採集脂肪組織後,身體狀況經醫師評估不適合繼續接受治療,或因其他無法預期因素,未能按原治療計畫完成療程,如治療期間死亡、發生併發症等,於採集脂肪組織後的10天內(日曆天),因細胞製備已接近完成,尚未進行各項放行檢測,病人須提供相關文件證明,單劑型療程醫院將退回108,000元,雙劑型療程醫院將退回137,000元。10天後(日曆天),因產品製備程序已完成,且各項放行檢測已進行,醫院仍須依表訂第一階段費用收費,無法退費。 4. V5療效指標未達:病人於細胞注射後一個月回診追蹤,VAS-Daily、IKDC分數和醫師評估的Tegner Lysholm Scaling Score皆未達10%改善,醫院僅收約540元的掛號費與診察費。 5. 當病人感受與醫師評估有爭議時,以病人感受VAS-Daily、IKDC分數為主,即病人感受VAS-Daily、IKDC分數,於細胞注射後一個月回診追蹤皆未達10%改善,醫院僅收約540元的掛號費與診察費。 |
| 計畫書核准期間(起日) | 2019/12/26 |
| 計畫書核准期間(迄日) | 2022/12/25 |
| 細胞製備場所 | 艾默生物醫學股份有限公司細胞產品製造區 |
| 細胞製備場地址 | 新北市淡水區中正東路二段29-1號8樓 |
| 附檔 | 無 |
台灣尖端先進生技
十二月 31, 2019| 申請案號 | 108DOMA008 |
| 計畫狀態 | 執行中 (On Going) |
| 細胞治療項目 | 自體免疫細胞治療- CIK |
| 適應症 | 實體癌第四期 |
| 適應症詳述 | 第IV 期實體癌症,其中包括肺癌、食道癌、胃癌、大腸結腸癌、乳癌、肝癌、腎臟癌和腦瘤。 |
| 醫療機構規模 | 醫學中心 Medical Center (佛教慈濟醫療財團法人花蓮慈濟醫院) |
| 醫療機構所在行政區 | 花蓮縣 |
| 醫療機構地址 | 970 花蓮市中央路三段707號 |
| 連絡資訊 | http://hlm.tzuchi.com.tw/ 03-8561825#12104 kevinlcc1234@gmail.com |
| 全部操作醫師 | 血液腫瘤:李啟誠、黃威翰、王佐輔 神經外科:林欣榮、邱琮朗、蔡昇宗 |
| 費用說明 | (費用尚待地方衛生局核定) 一個療程4劑,共收取109萬元 (篩檢費 4000元,製劑製作費 2.4萬元,第1~4劑 24萬元,末期款 10.2萬元) |
| 費用收取方式 | (費用尚待地方衛生局核定) 依執行進度計算應繳費用。(篩檢費 4000元,製劑製作費 2.4萬元,第1~4劑 24萬元,末期款 10.2萬元) 退費原則: 任一時間病人放棄未完成療程:病人隨時可以與醫生討論經雙方同意,病人隨時可放棄原細胞治療病人同意書之療程,則依原簽署同意書及其細胞製劑培養狀況,經雙方同意後支付當時已發生之相關費用。在治療及細胞製造過程中可依原設計不同的製程時間點,來控管此產品在製程過程當中產生之成本,減少消費者和製造商及醫院間之誤會,因此提供此相對合理的付款機制。施打當天未完成療程可分為因病人因素與非病人因素,若為病人因素則需要負擔每一次產生醫療費用與細胞製劑生產費用,若為非病人因素則只需負擔已產生的醫療費用,並退起始細胞製劑費用(2萬元)。 |
| 計畫書核准期間(起日) | 2019/08/22 |
| 計畫書核准期間(迄日) | 2022/08/22 |
| 細胞製備場所 | 台灣尖端先進生技醫藥股份有限公司 |
| 細胞製備場地址 | 221新北市汐止區康寧街169巷25號 4樓 |
| 附檔 | 無 |
光麗生醫
十二月 31, 2019| 申請案號 | 108DOMA010 |
| 計畫狀態 | 執行中 (On Going) |
| 細胞治療項目 | 自體免疫細胞治療- CIK |
| 適應症 | 實體癌第四期 |
| 適應症詳述 | 實體癌第四期:大腸直腸癌、乳癌、肺癌、子宮頸癌、卵巢癌 、腎臟癌、肝癌、胰臟癌、鼻咽癌、胃癌、食道癌、膽管癌 |
| 醫療機構規模 | 區域醫院 Regional Hospital |
| 醫療機構所在行政區 | 臺北市 |
| 醫療機構地址 | 臺北市信義區吳興街250號 |
| 連絡資訊 | https://www.tmuh.org.tw/ (02)27372181 ext 3312 kdlee1964@gmail.com |
| 全部操作醫師 | 李冠德、劉明哲、蕭世欣 |
| 費用說明 | 一個療程4劑,共收取108萬元 (細胞培養費用15萬元+細胞回輸治療費用9.5萬)*4劑+尾款10萬 |
| 費用收取方式 | (一 )自體免疫 CIK 細胞治療收費以療程計算: 每次CIK 細胞培養前先收取新 台 幣 150,000 元細胞培養費用,於該次 CIK 回輸治療完成後再收取新台幣 95,000 元的細胞回輸治療費用,待病人完成全部 4 次療程後,經第一次評估確定腫瘤大小仍然穩定控制時,收 取最後尾款100,000 元。 總費用(15 萬 +9.5 萬 )*4 次 +10 萬 =108 萬 (二) 若該次細胞培養無法產生符合規格之細胞製品 (含檢體量不足),將免費再培養一次,病人無須多付額外費用。 |
| 計畫書核准期間(起日) | 2019/11/15 |
| 計畫書核准期間(迄日) | 2022/11/14 |
| 細胞製備場所 | 光麗生醫實驗中心-免疫細胞產品操作室(R563) |
| 細胞製備場地址 | 221 新北市汐止區康寧街169 巷31 號11 樓之1 |
| 附檔 | 無 |
國際級生醫加速器SmartLabs在臺設立海外第一個據點
十二月 31, 2019科技部與SmartLabs共同建構國際級的生醫新創基地,科技部所引進國際級生醫加速器SmartLabs於今(16)日正式成立籌備處,進駐新竹生醫園區,與科技部共同建構國際級的生醫新創基地,預計明(109)年2月正式啟動SmartLabs海外的第一個營運據點。
特管法首例通過自體脂肪幹細胞治療退化性關節炎 (亞東醫院+艾默生醫)
十二月 30, 201912/26 衛福部公告更新的特管法通過案件,首例通過自體脂肪幹細胞治療退化性關節炎及膝關節軟骨缺損,這是第一項核准用於退化性關節炎的治療項目,這對同樣正在申請幹細胞治療特管辦法申請案的其他醫療院所具有指標性的意義。
New Articles
Cell Therapy















![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)