研究成果於2019年12月登上《自然通訊》(Nature Communications),也已申請多國專利,未來將有助於發展新穎的癌症治療藥物。
【英雄如何變為反派?】
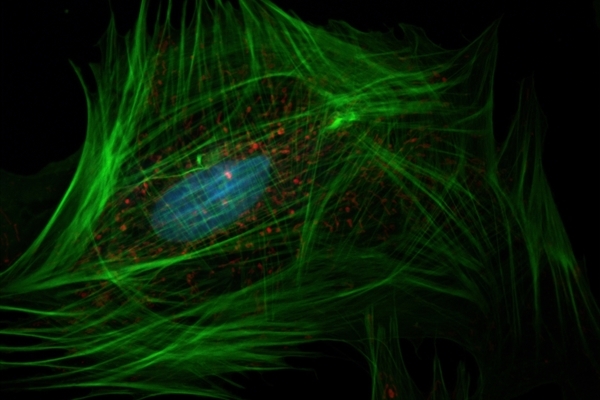
2018年,周玉山研究發現大量的PSPC1基因會促使癌細胞增生轉移。本次研究則進一步瞭解來龍去脈。PSPC1可以控制蛋白質於細胞核與細胞質間的進出,而在正常的細胞核裡,有一種酵素PTK6,它原本是會箝制住PSPC1、避免細胞癌化的「英雄」。然而,一旦PSPC1基因大量產生或發生突變,PTK6酵素便不再與PSPC1互相作用,反而會自行移動到細胞質中,並變成有致癌效果的「反派」。
除此之外,由於PSPC1異常表現,觸發了種種後續反應,均進一步加速癌細胞的轉移!原本應該在細胞質的蛋白質β-catenin,也會因PSPC1的失控而進入到細胞核內,而刺激蛋白質Wnt3a的細胞自我分泌,造成另一套致癌反應。經過這一系列過程,癌細胞會變成移動力更強的「上皮至間質細胞」(EMT),或變形力更強的「癌幹細胞」(CSC)。同時,細胞內「轉化生長因子-β1」(TGF-β1)的致癌特性也會被活化。
【研發抗癌抑制劑提升肝癌小鼠存活率!】
然而,瞭解PSPC1的作用機制,還不能解決癌細胞移轉的問題。因此,團隊更精準地定位出PSPC1與PTK6作用的關鍵點:「523號突變點」(Phospho-Y523-PSPC1),並藉此開發出「PSPC1抗癌抑制劑」(PSPC1-CT131)。
研究團隊從病人的肝癌組織中證實,「523號突變點」可作為生物標記,只要偵測出「523號突變點」在肝癌組織中減少,就表示PSPC1造成的致癌機制已被活化。而團隊研發的「PSPC1抗癌抑制劑」,便可有效使小鼠體內的PSPC1正常表現,進而控制致癌分子的路徑,延長肝癌小鼠的存活率。
周玉山強調,根據臨床數據統計,約有60~70%的癌症患者,其體內PSPC1基因都有大量表現。研究團隊從十年前發現並研究此一基因至今,終於近二年連續取得突破性進展。透過本次研究成果,我們未來可藉由檢測病患癌組織中「523號突變點」的表現程度,來預測腫瘤惡化的可能性。而「PSPC1抗癌抑制劑」則有對PSPC1及PTK6雙重抑制的效果,若可以用來控制腫瘤惡化與腫瘤轉移,將提升病患存活的機會,對癌症治療創造更具體的貢獻。
論文第一作者為本院博士後研究學者藍耀東。本院生醫所周玉山研究員領導的團隊,感謝臺北醫學大學癌症生物學與藥物研發研究所陳忻怡助理教授、癌症轉譯研究中心李雨青副研究員以及本院生物化學研究所陳瑞華特聘研究員協助。研究經費由中研院及科技部計畫共同支持。

圖說:(a)正常細胞核裡的酵素PTK6是會箝制住PSPC1、避免細胞癌化的「英雄」。(b)一旦PSPC1基因大量產生或發生突變,PTK6酵素反而會自行移動到細胞質中,變成有致癌效果的「反派」。原本應在細胞質的蛋白質β-catenin,也會因PSPC1的失控而進入到細胞核內,造成另一套致癌反應。(c)針對「523號突變點」,團隊研發的「PSPC1抗癌抑制劑」可有效使小鼠體內的PSPC1正常表現,進而延長肝癌小鼠的存活率。
資訊來源: 中央研究院














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)