Biologics World Taiwan 已穩步確立其地位,成為台灣的生物製藥聚會,以尋求新的合作夥伴關係,構想和知識。它的參會人數年復一年地增長了一倍,有100%的參會者認為這次會議是一次非常有益的體驗。我們很自豪能夠繼續提供會議平台,使台灣的生物製藥產業處於發展中的中心地位,在其新生物藥物研發和生物製造的快速發展方面受到越來越多的全球關注。
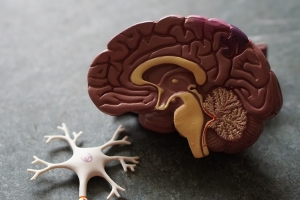
免疫療法可以成功治療神經膠母細胞瘤(GBM)嗎?
一月 16, 2020藉由免疫系統參與攻擊腫瘤而起作用的癌症治療方法已被證明可有效抵抗越來越多的癌症。到目前為止,一個值得注意的例外是腦癌,包括成膠質細胞瘤(Glioblastoma multiforme, GBM),這是成人中最常見的腦癌類型,也是原位腦癌中最惡性最棘手的腦瘤。儘管數十年來一直在努力開髮膠質母細胞瘤的新療法,但沒有一個能明顯改善患者的壽命。實際上,大多數患有這種腦癌的人存活不到2年。
2020.03.20 l 幹細胞與再生醫學國際研討會(基礎研究、產學應用、法規探討)
一月 10, 2020為更落實推動國內幹細胞與再生醫學相關產業與國際接軌,由科技部推動成立的「人類疾病誘導型多潛能幹細胞服務聯盟」與中央研究院生醫所謹訂於109年3月20日舉辦「2020 幹細胞與再生醫學國際研討會: 基礎研究、產學應用、法規探討」研討會。
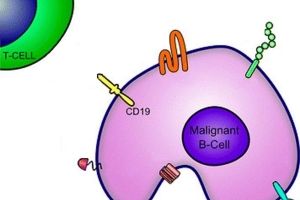
深入認識CAR-T免疫細胞療法
一月 08, 2020多年來,癌症治療的基礎是手術,化學療法和放射療法。在過去的二十年中,Gleevec® 和Herceptin®等抗體標靶治療藥物透過能辨認癌細胞中的特定分子變化而達到殺癌細胞的藥物,也已鞏固了它們作為許多癌症的標準治療方法。 但是在過去的幾年中,免疫療法已成為一種被癌症界稱為癌症治療的“第五支柱”的療法,這種療法具有增強和增強患者免疫系統攻擊腫瘤的能力。
FDA批准CAR T用於成人非霍奇金淋巴瘤治療
九月 01, 20182018年5月1日,美國食品藥品監督管理局(FDA)批准了針對患有某些類型的非霍奇金淋巴瘤的成年人的CAR T細胞療法tisagenlecleucel(Kymriah),使其成為第二種被FDA批准用於淋巴瘤的 CAR T細胞療法。
立法院三讀通過醫療器材管理法草案,醫療器材產業邁入新紀元
一月 06, 2020立法院於2019.12.13 日三讀通過「醫療器材管理法」,將醫療器材之管理由過去「藥事法」中抽離,並增訂產品來源及流向資料之建立、部分低風險醫療器材採行電子化登錄、彈性核定許可證效期及業者主動通報義務等制度,不僅加速產品上市的期程嘉惠病患,更能推動產業發展,健全醫療器材之管理制度。
國光生技啟動全方位廠區願景 規劃新建細胞培養廠及破傷風疫苗廠
一月 06, 2020因應市場國際化、技術多元化與產品多樣化的布局,國光生物科技股份有限公司(股票代碼:4142)目前已擬訂「全方位生技廠區」願景計畫,即將興建新的細胞培養廠、破傷風疫苗廠、增擴支援系統及倉儲、品管實驗室及辦公室等。
必治妥施貴寶(BMS)宣布將CAR-T細胞療法liso-cel許可申請提交給FDA
一月 05, 2020必治妥施貴寶(NYSE:BMY)2019/12/18宣布向美國食品藥品監督管理局(FDA)提交其lisocabtagene maraleucel(liso-cel)許可證申請(BLA)。此為自體抗CD19嵌合抗原受體(CAR)T細胞免疫療法,用於治療成年後復發或難治性(R / R)大B細胞淋巴瘤(LBCL)。
2020.06.19 l 2020(第十一屆)細胞治療國際研討會
一月 04, 2020會議將邀請國內外頂尖的細胞治療基礎研究和臨床專家,瞄準細胞治療研究的最新研究動態和進展, 圍繞上市從細胞治療的臨床監管、治療規範、細胞治療安全性,新型細胞治療技術、實體瘤治療、腫瘤免疫檢查點抑製劑、間充質乾細胞、幹細胞移植治療、基因編輯與細胞治療、細胞治療生產製造工藝等熱門議題進行討論。
提供藥物化學加值服務 帶動生技製藥產業升級 - 國衛院藥物化學加值創新研發中心揭牌儀式
一月 04, 2020隨著全球新藥銷售市場競爭日益激烈,藥物研發難度不斷提高,因應這樣的趨勢,目前國際藥廠多採取將新藥物開發鏈中不同階段的試驗項目,交給委託研究/製造機構(contract research organization/contract manufacturing organization, CRO/CMO)執行的策略,以達縮短新藥研發週期、減省研發成本與加速新藥上市的目標。
New Articles
Cell Therapy















![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)