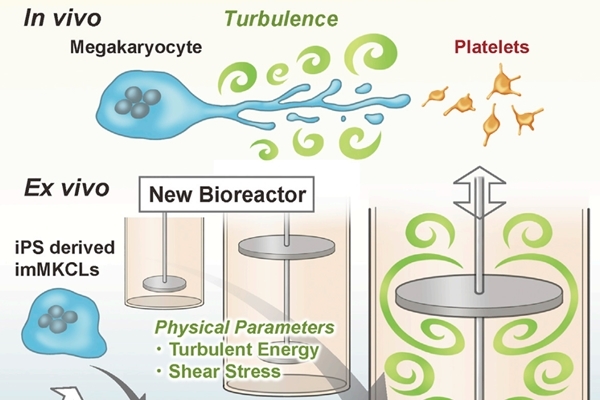
研究團隊在動物實驗中,發現透過這種方法製作出的血小板在體內的確具有生理活性。這代表人類未來也許不需依靠捐血的方式來獲取血小板,也許可透過工業化的生產來隨時滿足血小板臨床需求。在美國每年約有450萬人次的輸血需求,目前主要的來源都是依靠捐贈者,但隨著人口老齡化的增加,特別是發達國家,其捐血量可能無法滿足病患的需求,也因此若能透過細胞培養的方式來量產血小板,在臨床上的應用將會是非常有意義的。
而透過iPSC來製造血小板並非新聞,研究人員藉由基因改造的技術先將hiPSC進一步分化為巨核細胞,也就是hiPSC-derived megakaryocytes (hiPSC-MKs),研究人也發現透過在iPSC細胞內大量表現c-MYC, BML1及BCL-XL這三個基因時,可以培養出可持續無限生長分裂的巨核細胞株(immortalized megakaryocyte cell line, imMKCLs),接著在其培養基中再加入不同的生長因子並配合基因表現的調控,則可以讓imMKCLs進行增生及製造出血小板,但到目前為止尚未有研究能成功在體外大量的製造出具有能發揮實際臨床功能的血小板,通常每次臨床應用的需求量就需要2000億~3000億個血小板。
而在之前以小鼠為模型的動物實驗中發現,要促使血小板生成的主要關鍵是細胞在血液流動的過程中對細胞所自然產生物理性剪應力(shear stress),也因此研究人員也嘗試使用20L WAVE bag bioreactor來測試,但發現細胞雖然能增生,但能產出的血小板量則非常少,推論原因可能是WAVE系統無法提供足夠的剪應力。也因此研究團隊自行開發設計出新型的生物反應器,稱 VerMES biorecator,此反應器內設有兩個一大一小的層板,當層板上下移動時,因流體力學的作用反應器內的液體會產生渦流(turbulence)現象,製造出垂直方向的渦流擾動。
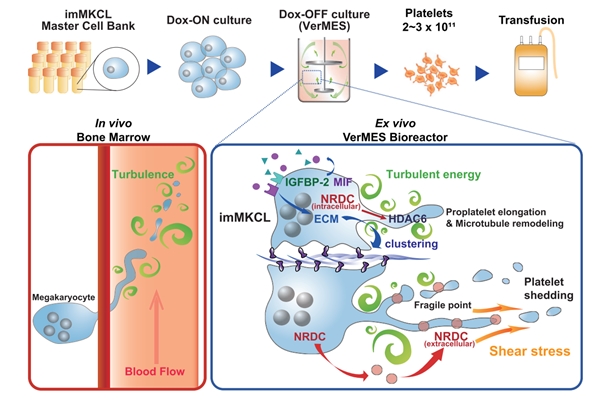
經過進一步的實驗研究團也發現渦流擾動是促使imMKCLs在體外能大量生成血小板的關鍵因素,在8L的的反應器中大約能產出約1000億個血小板。未來研究團隊也將持續以VerMES bioreactor搭配連續式離心濃縮的方式來持續優化血小板量產的流程,並以建立出能符合臨床應用等級並可大規模量產的製程為目標。
在此研究中我們可以看到許多生物技術的融和及跨領域的結合,,幹細胞技術搭配基因編輯和工程力學的設計造就了新的可能性,未來人類血小板的供應有可能會有新的來源,不受捐血量的影響而可源源不絕的供應。
參考資料: lto et al., Turbulence Activates Platelet Biogenesis to Enable Clinical Scale Ex Vivo Production, Cell (2018)














![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)