新型乳房腫瘤治法 國衛院開發戒指系統
台灣醒報
九月 17, 2021
乳癌是國內女性十大癌症第一名,常見的治療方法為外科切除手術,輔以放射線治療或化學藥物治療。近年來,非侵入高能聚焦超音波消融術 (HIFU ablation),又稱「海扶刀」,提供了無法承受麻醉開刀手術風險的病患另一種治療選擇,但仍有長時間手術造成皮膚、肌肉骨骼乃至臟器燒傷的風險。
打通血路!破解癌細胞詭計! 導正腫瘤微環境 增強癌症免疫療法
BioMAP
八月 18, 2021
癌症已連續39年蟬聯國人10大死因之首,持續對國人生命健康構成莫大威脅,但近年因免疫療法的出現,讓癌症治療出現一道曙光。然而,癌細胞誘發周邊環境產生慢性發炎反應、雜亂增生的血管與極化的巨噬細胞抑制了免疫反應,讓癌細胞逃避免疫細胞監控,使免疫檢查點抑制劑對實體腫瘤的有效反應率只有20~30%,因此調控腫瘤微環境就是成功治療的關鍵。
淺談mRNA藥物發展近況
BioMAP
八月 17, 2021
管控下疫情漸受控制,但距疫情前正常生活仍有差距,目前已有數個COVID-19疫苗取得緊急使用授權而上市,其中最受矚目的疫苗非Moderna及BioNTech所開發之兩個mRNA疫苗莫屬,這兩個mRNA疫苗的上市也開啟了mRNA臨床使用的大門。
肺癌惡化機制大發現!新研發抗體大幅降低癌症形成及轉移
BioMAP
八月 11, 2021
在癌症研究中,α-烯醇酶 (α-enolase, 又稱ENO1) 被發現高量表達於癌細胞。近期,中央研究院細胞與個體生物學研究所特聘研究員兼任生醫轉譯研究中心主任吳漢忠的研究團隊發表了一項研究,證實ENO1也存在癌細胞的細胞膜上,並且掌握了ENO1如何促進肺癌細胞生長與轉移,以及如何阻斷這項機制。研究成果已發表在國際期刊《癌症研究》(Cancer Research)[1]。
水膠化樹突細胞技術增強癌症免疫細胞療法
BioMAP
六月 30, 2021
免疫療法近年來在癌症臨床治療上帶來了新的契機,其中免疫細胞療法為極受矚目並被廣泛應用的治療方向,中研院生醫所的胡哲銘副研究員團隊研發出了一種新型的細胞水膠化技術,成功製備可長期保存並可調節呈現抗原的水膠化樹突細胞,並利用此技術提昇抗癌免疫細胞治療的成效。本研究已於6月7日刊登於<尖端材料> (Advanced Materials)。
迎戰新冠變種病毒 單醣化棘突蛋白疫苗提供更有效的保護
BioMAP
六月 04, 2021
新冠肺炎疫情爆發以來,已經造成全球一億七千萬人確診,並有超過三百五十萬人染疫死亡。時至今日雖已有許多COVID-19疫苗可供使用,但由於SARS-CoV-2病毒變種能力超強,極有可能擺脫當前疫苗誘發的保護,讓已經接種疫苗的人仍然有再被感染的可能性。如何讓疫苗具備應付變種病毒的能力,產生完整的保護,是當前急需解決的難題。
肺癌免疫治療新策略 去甲基化藥物促進 γδ T細胞抗癌療效
BioMAP
四月 27, 2021
肺癌多年來一直是國人癌症死因的首位,台大醫院公布最新的研究新成果,透過DNA去甲基化藥物,能促進 γδ T細胞」的抗癌療效,台大醫院研究團隊證實,以甲基化藥物治療肺癌細胞後,可大幅提高γδ T細胞的腫瘤毒殺作用,未來,亦可利用基因工程的方式,製成嵌合抗原受體重組γδ T細胞 (CAR-γδ T),將有助於各式創新的免疫治療策略,建立新的癌症治療準則,此研究已發表在4月12日的Nature雜誌。
研究:新冠肺炎溯源 2萬年前東亞曾出現
台灣醒報
四月 20, 2021
老祖先早就見識過新冠肺炎?英國與澳洲科學家公布最新初步報告,最早2.5萬年前東亞地區就曾出現新冠病毒並持續至5,000年前為止。雖然目前東亞地區受新冠肺炎疫情致死病例相對其他地區偏低,但科學家指出,這僅能證明基因確實會影響個人對病毒感染的反應方式,無法證實東亞人已具備免疫能力。
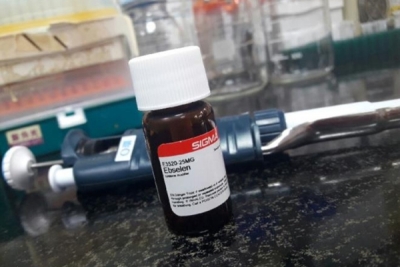
一加一大於二的創新策略 - 多靶向抑制SARS-CoV-2複製
BioMAP
四月 13, 2021
SARS-CoV-2病毒易變異和產生抗藥性,其中非結構性蛋白(nsp)在SARS-CoV-2複製過程扮演關鍵角色,然而目前大部分研究只鎖定特定的SARS-CoV-2複製蛋白。中央研究院生物醫學科學研究所林小喬特聘研究員、分生所袁小琀特聘研究員帶領研究團隊發現,藥物「雙硫侖(Disulfiram)」或藥物「依布硒(Ebselen)」,可以有效瞄準並瓦解多個參與病毒複製的非結構性蛋白質。
臺美合作研究大突破,冠狀動脈硬化基因治療新契機
BioMAP
四月 09, 2021
由臺北榮總、國立陽明交通大學與美國加州大學聖地牙哥分校(UCSD)錢煦院士所組成的臺美合作研究團隊研究發現:「信使核糖核酸(mRNA)的甲基化」可能是造成冠狀粥狀動脈硬化的原因之一,研究團隊利用基因療法抑制血管的「甲基化轉移?」,發現此方法能有效控制血管內發炎反應的產生並減少粥狀動脈硬化的發生,提供冠狀動脈疾病預防及治療新契機。
New Articles
Cell Therapy















![衛福部核可之細胞治療執行單位 [持續更新]](https://biomaptw.com/media/k2/items/cache/753a82091bdf93df272697e1f26229c2_XL.jpg)